Unidad de Modelos de Enfermedades Humanas en Drosophila (MEHD)

Líneas de investigación
Identificación y caracterización funcional de genes diana de la oncoproteína EWSR1::FLI1 característica de los sarcomas de Ewing
Los sarcomas de Ewing son un tipo de tumores de la infancia y la adolescencia que se caracterizan por la presencia de translocaciones cromosómicas que dan lugar a factores de transcripción quiméricos. La más frecuente de estas alteraciones cromosómicas fusiona el gen EWSR1 con el gen FLI1, dando lugar al factor de transcripción aberrante EWSR1::FLI1. EWSR1::FLI1 desempeña un papel fundamental en el desarrollo del sarcoma de Ewing, ya que regula la expresión de centenares de genes implicados en el proceso tumoral. En nuestro laboratorio combinamos el uso de tecnologías shRNA y CRISPR/Cas9 para generar modelos de enfermedad con las técnicas más avanzadas de análisis genómico y proteómico para identificar los genes implicados en el desarrollo del sarcoma de Ewing. El objetivo final es identificar genes diana que permitan el desarrollo y diseño de terapias dirigidas más eficaces y con menos efectos secundarios.
Unidad del Síndrome de Aceite Tóxico
El Síndrome del Aceite Tóxico (SAT), surgió bruscamente en España en mayo de 1981, asociándose al consumo de un aceite de colza desnaturalizado con anilina al 2% que había sido importado para usos industriales y, desviado con posterioridad al consumo humano previa refinación. Este incidente tuvo lugar en 1981 y para llevar a cabo la investigación de este nuevo síndrome se formó lo que en ese entonces se llamaría “Centro de Investigación del SAT (CISAT)”, años después se incluirían otras Enfermedades Raras (ER) dando lugar al “Centro de Investigación sobre el Síndrome del Aceite Tóxico y Enfermedades Raras (CISATER)” y finalmente quedaría integrada la estructura organizativa del actual en el Instituto de Investigación de Enfermedades Raras, plasmada en SCO/3158/2003.
Objetivos
El IIER está encargado de la investigación del SAT, tiene los siguientes objetivos:
1. Desarrollar y promover la investigación clínico-epidemiológica sobre el Síndrome del Aceite Tóxico (SAT).
2. Desarrollar y coordinar la investigación etiológica y patogénica relacionada con el origen de esta epidemia.
3. Describir la historia natural de la enfermedad conocida como Síndrome del Aceite Tóxico (SAT).
4. Custodiar y promover el registro de muestras biológicas y de aceites.
5. Asesorar a otros Organismos de la Administración, que mantienen competencias en el SAT, en aquellos aspectos relacionados con la evolución. de la enfermedad.
Líneas de Investigación
El objetivo principal de nuestro laboratorio es conocer los mecanismos implicados en la progresión de enfermedades raras y la búsqueda de posibles tratamientos. Para ello desarrollamos modelos animales en Drosophila melanogaster que reproduzcan fielmente las enfermedades humanas. Tras la validación del modelo, llevamos a cabo screenings genéticos o de compuestos aprobados por las agencias del medicamento con el objetivo de encontrar posibles dianas terapéuticas o principios activos que frenen el avance de la enfermedad.
Actualmente participamos en el programa SpainUDP con el fin de generar modelos de los casos no diagnosticados de este programa.
Además, estamos trabajando con modelos de enfermedades neurodegenerativas y tumores cerebrales de células gliales poco frecuentes que son actualmente incurables.
Descripción
Tumores cerebrales (Glioblastomas)
Estudio del efecto neurodegenerativo que causan los glioblastomas. En este proyecto describimos como el desarrollo de un glioblstoma (GB) causa una pérdida de sinapsis, y un declive cognitivo en los pacientes. Estudiamos los mecanismos de transporte vesicular implicados en el crecimiento tumoral y descubrimos el efecto beneficioso de la Brefeldina A como potencial tratamiento para proteger a las células del glioma de los cambios en el transporte vesicular.
Por otro lado, estudiamos las señales que median la comunicación entre GB y neuronas que median la progresión tumoral y la neurodegeneración. Descubrimos que las células de GB emiten unas proyecciones denominadas Tumor microtubes (TM) que facilitan la infiltración del tumor en el cerebro. Como consecuencia las células de GB roban Wg a las neuronas sanas y causa la pérdida de sinapsis y la muerte neuronal, por otro lado, las células de GB aumentan la señalización de la vía de Wg, lo que facilita la proliferación, la activación de la ruta JNK y la acumulación y secreción de MMP1.
Por último, en nuestro trabajo más reciente en este proyecto describimos como la expresión y secreción desde las células de GB de ImpL2 (Antagonista de la ruta de la insulina), causa una reducción en la señalización de la ruta de la insulina en neuronas, alteraciones mitocondriales y reducción del número de sinapsis. Estos efectos no autónomos del GB sobre la neurona, facilitan el crecimiento del tumor.
Este proyecto novedoso ha puesto de manifiesto la visión del glioblastoma como una enfermedad neurodegenerativa, y ha demostrado que la afectación neuronal juega un papel decisivo en la progresión del tumor, y en los síntomas y la muerte prematura.
Enfermedades raras:
Laminopatías (Lamina C)
En colaboración con el Dr. Ignacio Perez de Castro (IIER-ISCIII) en el desarrollo de modelos animales de laminopatía en Drosophila melanogaster. El gen LMNA en humanos codifica para las laminas A/C, que son unas proteínas de la envoltura nuclear esenciales para el mantenimiento de la integridad del núcleo. Mutaciones en este gen producen un conjunto de enfermedades conocidas como laminopatías, que incluyen varios tipos de distrofia muscular. Se ha identificado una forma mutante en heterocigosis del gen LMNA, causada por la sustitución de un aminoácido, en un paciente con Distrofia muscular Congénita asociada LMNA (L-CMD). Para evaluar si la mutación altera la función de la lamina, realizamos estudios in vivo usando Drosophila melanogaster como modelo. Esta mutación específica de la lamina C de Drosophila ha sido modelada a partir de la encontrada en el paciente y el fenotipo generado se comparó con el que causan otras mutaciones de LMNA, asociadas a la Distrofia Muscular de Emery Dreifuss Autosómica Dominante (AD-EDMD). La expresión de la mutación LamC mutada tiene un efecto dominante en el músculo de larva, produjo semi-letalidad en el estadio pupal y cambios citológicos como defectos en la morfología nuclear, agregación de la lamina C, reducción en el número de núcleos y fallos en la estructura de los sarcómeros. Los otros mutantes presentaron diferencias en el fenotipo, lo que indicó que mutaciones en distintos dominios de la proteína y en diferentes aminoácidos producen fenotipos diferentes.
Uso de compuestos para tratar la laminopatía
Estudios previos in vitro han demostrado que los compuestos que revierten los defectos en la morfología circular causadas por mutaciones en el gen LMNA tienen un efecto beneficioso. Con el objetivo de revertir el fenotipo patológico de las mutaciónes en LamC en Drosophila, estamos evaluando el efecto de diferentes compuestos químicos. El tratamiento revierte parcialmente el fenotipo observado en moscas con la mutación LamC, pero no fue capaz de recuperar la morfología circular del núcleo. Los resultados obtenidos hasta el momento nos muestran el potencial de estos tratamientos como estrategia terapéutica para la Distrofia Muscular Congénita asociada a LMNA.
Uso de terapia génica
Una de las propuestas para tratar a los pacientes con Distrofia Muscular Congénita asociada a LMNA es el uso de terapia génica para sustituir los genes mutados por sus formas no mutadas. Estas estrategias traen implícita la duda de si los fenotipos son reversibles o no. Para determinar la evolución de los músculos una vez restaurada la forma silvestre de la LMNA, hemos diseñado un proyecto en el que induciremos la expresión de formas mutadas de LMNA usando el sistema binario de expresión Gal4/UAS, y a diferentes momentos de la enfermedad revertiremos genéticamente la expresión LMNA mutada. Nos proponemos evaluar el efecto de esta reversión, y determinar si hay un punto de no retorno o, por el contrario, la distrofia muscular es reversible fenotípicamente, y funcionalmente.
Síndrome de Leigh (MIM#250620)
Desde 2020 colaboro con la asociación “Todos con Hugo” para el estudio de la Neurodegeneración por deficiencia en 3-hidroxisobutiril-CoA-hidrolasa. Hugo es el único paciente en España de un total de 12 pacientes en todo el mundo. Esta mutación afecta al metabolismo del aminoácido Valina y causa deterioro neurológico y muscular. Nosotros hemos generado un modelo en Drosophila melanogaster de falta de expresión que produce atrofia muscular, deterioro neurológico y muerte prematura. Este modelo es esencial para realizar un cribado de compuestos supresores y así buscar posibles soluciones.
Repositorio de modelos de Drosophila para enfermedades raras no diagnosticadas
El IIER dispone de una base de datos de casos de pacientes con enfermedades raras no diagnosticadas. Entre los datos disponibles, se han secuenciado las muestras de estos pacientes y se conocen los genes afectados en cada caso y las mutaciones concretas. Dentro de las líneas futuras de mi laboratorio se encuentra la creación de un repositorio de Drosophila que incluya las líneas transgénicas de cada uno de los genes de esta base de datos con el fin de estudiar in vivo el efecto de estas mutaciones, y generar modelos animales para estas enfermedades.
El tejido nervioso y muscular están muy conservados desde Drosophila hasta humanos y representan dos de los tejidos más afectados en las enfermedades raras.
1. cambios heredables causador por estrés en el desarrollo y la progresión de enfermedades. PID2022-139786OB-I00. MICINN. Instituto de Investigación de Enfermedades Raras (ISCIII). 2024-2026.
2. Estudio in vivo de tumores cerebrales pediátricos en Drosophila. PI22CIII/00062. MICINN. Instituto de Investigación de Enfermedades Raras (ISCIII). 2023-2025.
3. Cribado de supresores para el Glioma Pontino Intrínseco Difuso (DIPG) en Drosophila. Fundación Unidos contra el DIPG.
4. Generación de un modelo de Drosophila para mutaciones de HIBCH en el síndrome de Leigh. Fundación “Todos con Hugo”.
5. Estudio in vivo de tumores cerebrales en Drosophila.
Unidad de Investigación en Modelos y Mecanismos
Las principales Líneas de Investigación llevadas a cabo son:
• Generación de modelos celulares, principalmente líneas celulares pluripotentes inducidas (iPSC), para el diagnóstico y estudio de enfermedades raras.
• Estudio de mecanismos epigenéticos implicados en enfermedades raras
• Desarrollo de perfiles transcripcionales y epigenéticos para el diagnóstico de enfermedades raras en colaboración con el programa de casos sin diagnóstico SpainUDP del ISCIII
PROYECTOS:
Proyecto "Modelos y mecanismos de enfermedades ultrararas con base epigenética". Proyecto PID2021-128087OB-I00 financiado por MCIN /AEI /10.13039/501100011033 / FEDER, UE financiado por el Ministerio de Ciencia e Innovación
Proyecto "Optimización de terapias antisentido en un modelo neuronal de Síndrome de Kleefstra" financiado por la Fundación Inocente, Inocente y la Fundación Kleefstra España
Proyecto "Plaforma ISCIII de Biomodelos y Biobancos" financiado por el ISCIII
Unidad de Epigenética y Regulación Génica
Regulación epigenética de la identidad el músculo estriado y su implicación en enfermedades raras del tipo de las miopatías idiopáticas y problemas de conducción cardiaca, tales como la fibrilación atrial y el bloqueo atrioventricular. Ensayos Funcionales de Nuevas Mutaciones en Enfermos no Diagnosticados.
Proyecto PID2020-114773GB-I00 (AEI/10.13039/501100011033) financiado por:
Terapias Farmacológicas
Análisis de las alteraciones del sistema inmune presentes en las enfermedades raras.
- Estudio e identificación de nuevos reguladores de los procesos inflamatorios,
- (Papel de la inflamación y la polarización de los macrófagos en la patogénesis de las enfermedades pulmonares intersticiales difusas (EPID).
- (Establecer modelos animales para el estudio de los mecanismos implicados en las EPIDs. Diseño e identificación de nuevos agentes terapéuticos a partir de productos naturales.
- Diseño y síntesis de nuevos agentes terapéuticos.
- Estudio de los mecanismos de acción.
- Estudios toxicológicos.
- Nuevas formulaciones y liberación selectiva en órganos y tejidos.
Terapia Génica
Nuestro grupo está centrado en (i) la investigación de los mecanismos subyacentes a distintos tipos de tumores huérfanos y enfermedades raras y (ii) la búsqueda de nuevas estrategias terapéuticas para combatir las enfermedades raras.
Nuestras líneas de investigación están actualmente enfocadas en los tumores de la granulosa ovárica asociados a FOXL2, la leucoencefalopatía agresiva precoz relacionada con KARS1 y en las distrofias musculares congénitas asociadas a LMNA. En todos los casos el editado génico mediado por CRISPR es la aproximación terapéutica mayormente seleccionada.
Contamos con la siguiente financiación:
- Evolución de estrategias terapéuticas basadas en CRISPR/Cas con potencial para el tratamiento de la distrofia muscular congénita asociada a LMNA (PI23CIII/00041). Acción Estratégica en Salud Intramural ISCIII 2023. IP: Ignacio Pérez de Castro. 2025-27. 138000€.
- La vía de los glucocorticoides en la distrofia muscular congénita relacionada con LMNA: Descifrando mecanismos y probando estrategias terapéuticas (PID2023-147678OB-I00). Proyectos Generación de Conocimiento AEI 2023. IP: Ignacio Pérez de Castro. 2025-27. 275000€.
- Investigating the potential of Replacement Gene Therapy for Early-Onset Progressive Leukoencephalopathy using iPSCs and a Kras1 knock-in mouse model. Cure KARS Laia Foundation. IP: Ignacio Pérez de Castro. 2025-28. 250000€.
- Distrofias congénitas asociadas a LMNA. LCMD-Research Foundation. IP: Ignacio Pérez de Castro. 2026-27. 43000€.
El denominado CIAC (Centro de Investigación sobre Anomalías Congénitas) es un centro asociado del Instituto de Salud Carlos III (ISCIII), que tiene carácter de Unidad, para la investigación sobre ese amplio grupo de patologías, la mayoría enfermedades raras.
Dicha Unidad fue creada el 13 de febrero de 2002, tras firmarse un convenio de colaboración entre el ISCIII y la Universidad Complutense de Madrid, a la que se encontraba vinculada la Prof. Martínez-Frías, quien trasladó su grupo de investigación (Estudio Colaborativo Español de Malformaciones Congénitas-ECEMC) al ISCIII. En la ORDEN SCO/3158/2003, de 7 de noviembre, por la que se crea el Instituto de Investigación de Enfermedades Raras (IIER), se especifica que el IIER asume la coordinación técnica con esta Unidad.
El área de estudio desarrollada en la UIAC son las anomalías congénitas, que en su inmensa mayoría son Enfermedades Raras (ER). La particularidad de estas ER es que están presentes desde el momento del nacimiento, lo que implica que las personas afectadas van a tener que enfrentarse desde tan temprana edad a sus consecuencias (muchas de ellas sin posibilidades terapéuticas), que con frecuencia originan una dependencia crónica y una disminución considerable de la calidad de vida, tanto para la persona afectada como para su entorno más cercano. Muchas de ellas, además, incrementan sustancialmente la morbilidad y el riesgo de muerte precoz. Por consiguiente, la investigación sobre este tipo de patologías, que tanto impacto pueden tener sobre la vida de la persona (y su familia), tiene un gran interés dentro del área de las ER.
Para ello, llevamos a cabo una serie de Líneas de Investigación:
1. Investigación sobre los aspectos epidemiológicos (tanto descriptivos como analíticos y clínico-epidemiológicos) de niños recién nacidos con malformaciones y otros defectos congénitos. Investigación para la identificación y caracterización de factores teratogénicos en el ser humano.
2. Identificación de causas ambientales de los defectos congénitos en niños recién nacidos.
3. Investigación sobre los aspectos clínicos, genético-clínicos, dismorfológicos y patogénicos de los defectos congénitos. Investigación citogenética y genético-molecular de niños que nacen con malformaciones y otros defectos congénitos
El objetivo principal es la identificación de las causas de los defectos congénitos (DC) para favorecer la prevención primaria de este importante grupo de enfermedades raras, y que los niños nazcan sanos.
Objetivos específicos:
─ Investigar las causas (genéticas o ambientales) de los DC, en base al registro del ECEMC (Estudio Colaborativo Español de Malformaciones Congénitas).
─ Identificar teratógenos, factores de riesgo y medidas preventivas para estas patologías.
─Traslación de los resultados de investigación a los profesionales que pueden aplicarlos, especialmente para la prevención.
─ Contribuir a la formación (de profesionales sanitarios), información (a la población general) y difusión sobre DC y su prevención.
Proyectos financiados
PROYECTO: EUROCAT Joint Action
IP: H. Dolk, Reino Unido - ML Martínez Frías y Eva Bermejo en el ISCIII
Agencia financiadora: Executive Agency for Health and Consumers. EU Health Programme 2008-2013
Duración (periodo de financiación): 2011-2013
Expediente contrato/proyecto: Ref. 2010 22 04
El área de investigación “Epidemiología de las Enfermedades Raras" del Instituto de Investigación de Enfermedades Raras (IIER) forma parte de distintas redes de investigación nacionales e internacionales y participa diversos proyectos de investigación tanto nacionales como europeos o internacionales. Cabe destacar su participación como grupo investigador en el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y en la red de Biobancos del ISCIII (BioNER).
Objetivos
Los objetivos del grupo de “Epidemiología de las Enfermedades Raras" son los siguientes:
- Identificar la magnitud de las enfermedades raras, estableciendo un sistema de información de base epidemiológica.
- Promover la investigación clínica, básica, sociosanitaria y socieconómica de las enfermedades raras dentro del Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica (I+D+I).
- Elaborar y actualizar periódicamente un censo de los recursos de actividades en relación con las enfermedades raras.
- Impulsar y coordinar un banco de material biológico vinculado a las enfermedades raras. Impulsar la investigación relativa a las enfermedades raras en colaboración con los servicios de salud del Sistema Nacional de Salud.
- Procurar que se asegure una adecuada atención sanitaria a los pacientes con enfermedades raras en colaboración con los servicios de salud de las Comunidades Autónomas, y los coordinadores de las Redes de Investigación que sustenta el Instituto de Investigación de Enfermedades Raras.
- Promover acciones piloto de innovación en relación con la atención clínica y sociosanitaria en enfermedades raras, creando grupos de expertos que establezcan criterios de actuación, contribuyendo a elaborar protocolos clínico-terapéuticos de consenso.
- Investigar sobre las últimas causas y la patogenia del Síndrome del Aceite Tóxico.
- Impulsar la atención sanitaria de calidad y especializada de los enfermos del Síndrome del Aceite Tóxico.
Líneas de Investigación Prioritarias
Las principales líneas de investigación del grupo de “Epidemiología de las Enfermedades Raras" son:
- Epidemiología general de las Enfermedades Raras: morbilidad y mortalidad, costes sanitarios, carga de enfermedad y calidad de vida.
- Seguimiento de la cohorte de afectados por el Síndrome del Aceite Tóxico (SAT): estado de salud percibido, mortalidad, etc.
Plataformas de Apoyo a la Investigación
Además, este grupo cuenta con las siguientes Plataformas de Apoyo a la Investigación en ER:
- Registro de Pacientes de Enfermedades Raras (RePER) . y gestión del Registro Estatal de Enfermedades Raras (REER) del MSSSI (encomienda del Ministerio al IIER-ISCIII).
- Biobanco Nacional de Enfermedades Raras (BioNER).
Esta área ha desarrollado y coordina Programas de apoyo al diagnóstico como el Programa de Casos de Enfermedades Raras Sin Diagnóstico (SpainUDP) del IIER-ISCIII , en colaboración con su Área de Anomalías Congénitas (CIAC) y Área de Genética Humana (AGH-IIER Majadahonda).
Proyectos financiados
- Servidor interactivo de mortalidad debida a Enfermedades Raras en Europa: Una aproximación basada en SIG y cartografía inteligente. IP: Verónica Alonso Ferreira. Duración: 2024-2026. Referencia: IERPY 387/23 (PI23CIIII/00037).
- Cambios en la carga socio-económica de la epidermolisis bullosa en Europa. IP: Verónica Alonso Ferreira. Duración: 2022-2024. Referencia: AC21CIII_2/00002.
Desarrollo de terapias avanzadas para el tratamiento del sarcoma de Ewing
El tratamiento estandar del sarcoma de Ewing se basa en el uso de quimioterapia, radioterapia y cirugía. Aunque estos tratamientos son relativamente eficaces para algunos tumores localizados, son totalmente ineficientes en el caso de pacientes con tumores metastásicos o resistentes a los tratamientos convencionales. Como consecuencia de la falta de alternativas terapéuticas eficaces, tres de cada cuatro niños o adolescentes con tumores metastásicos o refractarios morirán por causa de la enfermedad. Es por tanto urgente desarrollar nuevas terapias para dar respuesta a este grupo de pacientes. En nuestro laboratorio estamos trabajando en el desarrollo de terapias disruptivas, que representen un enfoque totalmente novedoso para el tratamiento de esta enfermedad. Nuestra apuesta se basa en el uso de aproximaciones de terapia génica y el uso de vectores virales (principalmente adenovirus) y no virales (principalmente nanopartículas lipídicas) para vehiculizar las terapias a las células tumorales.
Genética Molecular
LINEAS DE INVESTIGACIÓN
- Nuevos modelos de organoides para la Investigación de enfermedades raras y sus aplicaciones biomédicas.
- Mecanismos moleculares del Déficit de alfa-1 antitripsina y su papel em la enfermedad pulmonar y hepática.
- Identificación de genes modificadores en el Déficit de Alfa-1 Antitripsina. Biomarcadores de susceptibilidad adesarrollar enfermedad hepática o pulmonar.
- Regulación del gen SERPINA1 y su papel en el Déficit de Alfa-1 Antitripsina.
- Investigación del Déficit de Esfingomielinasa Ácida tipo B (ASMD-B) y generación de biomodelos de enfermedad para el estudio de nuevas terapias
- Investigación de nuevas terapias para la fibrosis pulmonar idiopática.
PROYECTOS
1. Desarrollo de organoides pulmonares alveolares y caracterización de la función pulmonar en modelos de ratón como nuevos modelos in vitro e in vivo para ensayar nuevas terapias. Proyectos de Investigación SEPAR, Proyecto 1538. 01/06/2024-31/12/2026. IP: Beatriz Martinez Delgado. 18.000 euros.
2. Ayudas Atracción de Talento Investigador “César Nombela”. CAM. Carlos Benítez Buelga. Development of an ex vivo pulmonary fibrosis platform for identifying personalized therapies. 2023-T1/SAL-GL-29292. Contrato + Proyecto (178.780 €).
3. Plataforma de Biobancos y Biomodelos para Enfermedades raras y ultra-raras – Unidad BB-IIER. Plataformas ISCIII de apoyo a la I+D+I en biomedicina y ciencias de la salud. PT-23. PT23CIII/00003. IP:Beatriz Martinez Delgado. (Instituto de Investigación de Enfermedades Raras). 01/01/2024-31/12/2026. (144.000 €).
4. Identificación de variantes genéticas modificadoras del déficit de alfa-1 antitripsina mediante secuenciación masiva de exomas. Proyectos de Investigación SEPAR, Proyecto 1114. 01/01/2021-31/12/2022. IP: Beatriz Martinez Delgado. 18.000 euros.
5. Organoides de hígado para el estudio del Déficit de Alfa-1 Antitripsina. De las fases iniciales de la enfermedad a una estrategia terapéutica de edición génica. Proyectos de Investigación en Salud. AESI PI20CIII/00015. IP: Beatriz Martínez Delgado. (Instituto de Salud Carlos III). 01/01/2021-31/12/2023. 150.000 €.
6. Plataforma Biobancos y Biomodelos-Organoides del Instituto de Investigación de Enfermedades Raras. PT-20. Plataformas ISCIII de apoyo a la I+D+I en biomedicina y ciencias de la salud. PT20CIII/00009. IP:Beatriz Martinez Delgado. (Instituto de Investigación de Enfermedades Raras). 01/01/2021-31/12/2023. 111.000 €.
7. Identificación de factores genéticos modificadores en el Déficit de Alfa-1 Antitripsina, mecanismos de enfermedad hepática y desarrollo de organoides como modelo de enfermedad. Proyectos de Investigación en Salud. AESI PI17CIII/00042. Instituto de Salud Carlos III. IP: Beatriz Martinez Delgado. (Unidad de Genética Molecular, IIER,ISCIII). 01/01/2018- 31/12/2020. 112.000 €.
8. Organoid model of liver disease in alpha-1 antitrypsin deficiency. ALTA, Alpha-1 Antitrypsin Laurell's Training Award 2017. Nerea Matamala. (Unidad de Genética Molecular, IIER,ISCIII). 29/12/2017-29/12/2018. 50.000 €. Coordinador.
9. Implementación de tecnologías basadas en organoides. Biobanco y aplicaciones biomedicas. Desarrollo Tecnológico en Salud. DTS17CIII/00007. Instituto de Salud Carlos III. IP:Beatriz Martinez Delgado. (Unidad de Genética Molecular, IIER,ISCIII). 01/01/2018- 31/12/2019. 80.500 €.
Biotecnología Celular
Desarrollo de Terapias Avanzadas como CAR T, virus oncolíticos o Terapias Celulares Investigación en Cáncer Infantil. Esta línea pone su principal foco en el desarrollo de inmunoterapias, aunque también estudiamos el desarrollo y evolución de los tumores sólidos, especialmente sarcomas infantiles. Desarrollo de Terapias Celulares en Enfermedades Raras. Esta línea se basa, principalmente, en la utilización de células progenitoras mesenquimales como tratamientos en patologías de base inmune o regeneración de tejidos mesodérmicos.
Publicaciones destacadas
Identification of Novel Short C-Terminal Transcripts of Human SERPINA1 Gene
Matamala N, Aggarwal N, Iadarola P, Fumagalli M, Gomez-Mariano G, Lara B, Martinez MT, Cuesta I, Stolk J, Janciauskiene S, Martinez-Delgado B. Identification of Novel Short C-Terminal Transcripts of Human SERPINA1 Gene. PLoS One. 2017 Jan 20;12(1):e0170533.
PUBMED DOISpanish Registry of Patients With Alpha-1 Antitrypsin Deficiency: Database Evaluation and Population Analysis
Lara B, Blanco I, Martínez MT, Rodríguez E, Bustamante A, Casas F, Cadenas S, Hernández JM, Lázaro L, Torres M, Curi S, Esquinas C, Dasí F, Escribano A, Herrero I, Martínez-Delgado B, Michel FJ, Rodríguez-Frías F, Miravitlles M. Spanish Registry of Patients With Alpha-1 Antitrypsin Deficiency: Database Evaluation and Population Analysis. Arch Bronconeumol. 2017 Jan;53(1):13-18.
PUBMED DOIWhy do some adults with PiMZ alpha1-antitrypin develop bronchiectasis?
Nupur Aggarwal, Beatriz Martinez Delgado, Salipalli Sandeep, Nerea Matamala, Jessica Rademacher, Nicolas Schwerk, Tobias Welte, Sabina Janciauskiene, Felix C. Ringshausen. Why do some adults with PiMZ alpha1-antitrypin develop bronchiectasis?. European Respiratory Journal. Open Res. 2016 Jun 6;2(2). pii: 00021-2016.
PUBMED DOIAlpha1-antitrypsin regulates transcriptional levels of serine proteases in blood mononuclear cells
Nupur Aggarwal*, Janine Kropke*, Nerea Matamala, Beatriz Martinez-Delgado*, Maria Teresa Martínez, Heiko Golpo, Jan Stolk, Sabina Janciauskiene, Rembert Koczulla. Alpha1-antitrypsin regulates transcriptional levels of serine proteases in blood mononuclear cells. American Journal of Respiratory and Critical Care Medicine 2016, 193(9):1065-1967. (*same contribution).
PUBMED DOIAlternative transcripts of the SERPINA1 gene in alpha-1 antitrypsin deficiency
Matamala N, Martínez MT, Lara B, Pérez L, Vázquez I, Jimenez A, Barquín M, Ferrarotti I, Blanco I, Janciauskiene S, Martinez-Delgado B. Alternative transcripts of the SERPINA1 gene in alpha-1 antitrypsin deficiency. J Transl Med 2015 Jul 4;13:211.
PUBMED DOISevere Alpha-1 Antitrypsin Deficiency in composite heterozygotes carrying a new splicing mutation QOMadrid
Beatriz Lara, Maria Teresa Martínez, Ignacio Blanco, Ilaria Ferrarotti, Francisco Rodriguez-Frias, Laura Perez, Irene Vazquez, Javier Alonso, Manuel Posada, Beatriz Martínez-Delgado. Severe Alpha-1 Antitrypsin Deficiency in composite heterozygotes carrying a new splicing mutation QOMadrid. Respiratory Research (2014), 15(1):125.
PUBMED DOIGenome-wide profiling of non-smoking-related lung cancer cells reveals common RB1 rearrangements associated with histopathologic transformation in EGFR-mutant tumors
Pros E, Saigi M, Alameda D, Gomez-Mariano G, Martinez-Delgado B, Alburquerque-Bejar JJ, Carretero J, Tonda R, Esteve-Codina A, Catala I, Palmero R, Jove M, Lazaro C, Patiño-Garcia A, Gil-Bazo I, Verdura S, Teulé A, Torres-Lanzas J, Sidransky D, Reguart N, Pio R, Juan-Vidal O, Nadal E, Felip E, Montuenga LM, Sanchez-Cespedes M. Genome-wide profiling of non-smoking-related lung cancer cells reveals common RB1 rearrangements associated with histopathologic transformation in EGFR-mutant tumors. Ann Oncol. 2020 Feb;31(2):274-282.
PUBMED DOI-
Miguel Ángel Rodriguez Milla
E. Científico Titular de OPIs (A3)
Código ORCID: 0000-0002-2640-5888
BIOTECNOLOGÍA CELULAR
-

-

-
Sonsoles Hortelano Blanco
Jefe de Unidad. Investigador Científico OPIs
-

-
Pablo Gómez del Arco
Científico Titular-Investigador Principal
-

Sergio Casas Tintó
E.Científico Titular de OPIs (A3), Jefe de Unidad
Código ORCID: 0000-0002-9589-9981
UNIDAD DE MODELOS DE ENFERMEDADES RARAS HUMANAS EN DROSOPHILA
-

Eva Bermejo-Sánchez
E. Investigadores Científicos de OPIs (A2). Directora del IIER
Código ORCID: https://orcid.org/0000-0001-7282-2714
DIRECCIÓN INSTITUTO DE INVESTIGACIÓN DE ENFERMEDADES RARAS (IIER)
-

María Eva Bermejo Sánchez
E. Investigadores Científicos de OPIs (A2). Directora del IIER
Código ORCID: 0000-0001-7282-2714
-

María Eva Bermejo Sánchez
E. Investigadores Científicos de OPIs (A2). Directora del IIER
Código ORCID: 0000-0001-7282-2714
DIRECCIÓN INSTITUTO DE INVESTIGACIÓN DE ENFERMEDADES RARAS (IIER)
-

María José Barrero Núñez
E. Científico Titular de OPIs (A3), Jefe de Unidad
Código ORCID: 0000-0002-5990-7040
UNIDAD DE MODELOS Y MECANISMOS
-

Francisco Javier Alonso García de la Rosa
Profesor de Investigación de OPIs. Jefe de grupo
Código ORCID: 0000-0002-6287-8391
-

Sheila Ramos del Saz
Técnico de Laboratorio
Código ORCID: 0000-0002-4831-0353
UNIDAD DE MODELOS Y MECANISMOS
-

-
Alfonso Luque Jiménez
Investigador Distinguido
-
Javier García Castro
IP, E. Profesor de Investigación (A1)
Código ORCID: 0000-0001-7604-1640
BIOTECNOLOGÍA CELULAR
-
Saint Thomas Cervera Mayor
Investigador predoctoral
-
Verónica Alonso Ferreira
E. Investigadores Científicos de OPIs (A2). Jefa del Área de Epidemiología.
Código ORCID: 0000-0002-8560-1336
EPIDEMIOLOGÍA DE ENFERMEDADES RARAS
SÍNDROME DEL ACEITE TÓXICO
CIBERER
-
Verónica Alonso Ferreira
E. Investigadores Científicos de OPIs (A2). Jefa del Área de Epidemiología.
Código ORCID: 0000-0002-8560-1336
EPIDEMIOLOGÍA DE ENFERMEDADES RARAS
SÍNDROME DEL ACEITE TÓXICO
CIBERER
-
Fadoua Abdellaoui Soussi
Becaria FPI-MINECO
Listado de personal
Información adicional
Tumores cerebrales (Glioblastomas) Estudio del efecto neurodegenerativo que causan los glioblastomas. En este proyecto describimos como el desarrollo de un glioblstoma (GB) causa una pérdida de sinapsis, y un declive cognitivo en los pacientes. Estudiamos los mecanismos de transporte vesicular implicados en el crecimiento tumoral y descubrimos el efecto beneficioso de la Brefeldina A como potencial tratamiento para proteger a las células del glioma de los cambios en el transporte vesicular. Por otro lado, estudiamos las señales que median la comunicación entre GB y neuronas que median la progresión tumoral y la neurodegeneración. Descubrimos que las células de GB emiten unas proyecciones denominadas Tumor microtubes (TM) que facilitan la infiltración del tumor en el cerebro. Como consecuencia las células de GB roban Wg a las neuronas sanas y causa la pérdida de sinapsis y la muerte neuronal, por otro lado, las células de GB aumentan la señalización de la vía de Wg, lo que facilita la proliferación, la activación de la ruta JNK y la acumulación y secreción de MMP1.
Por último, en nuestro trabajo más reciente en este proyecto describimos como la expresión y secreción desde las células de GB de ImpL2 (Antagonista de la ruta de la insulina), causa una reducción en la señalización de la ruta de la insulina en neuronas, alteraciones mitocondriales y reducción del número de sinapsis. Estos efectos no autónomos del GB sobre la neurona, facilitan el crecimiento del tumor. Este proyecto novedoso ha puesto de manifiesto la visión del glioblastoma como una enfermedad neurodegenerativa, y ha demostrado que la afectación neuronal juega un papel decisivo en la progresión del tumor, y en los síntomas y la muerte prematura. Enfermedades raras Laminopatías (Lamina C) En colaboración con el Dr. Ignacio Pérez de Castro (IIER-ISCIII) en el desarrollo de modelos animales de laminopatía en Drosophila melanogaster. El gen LMNA en humanos codifica para las laminas A/C, que son unas proteínas de la envoltura nuclear esenciales para el mantenimiento de la integridad del núcleo. Mutaciones en este gen producen un conjunto de enfermedades conocidas como laminopatías, que incluyen varios tipos de distrofia muscular. Se ha identificado una forma mutante en heterocigosis del gen LMNA, causada por la sustitución de un aminoácido, en un paciente con Distrofia muscular Congénita asociada LMNA (L-CMD).
Para evaluar si la mutación altera la función de la lamina, realizamos estudios in vivo usando Drosophila melanogaster como modelo. Esta mutación específica de la lamina C de Drosophila ha sido modelada a partir de la encontrada en el paciente y el fenotipo generado se comparó con el que causan otras mutaciones de LMNA, asociadas a la Distrofia Muscular de Emery Dreifuss Autosómica Dominante (AD-EDMD). La expresión de la mutación LamC mutada tiene un efecto dominante en el músculo de larva, produjo semi-letalidad en el estadio pupal y cambios citológicos como defectos en la morfología nuclear, agregación de la lamina C, reducción en el número de núcleos y fallos en la estructura de los sarcómeros. Los otros mutantes presentaron diferencias en el fenotipo, lo que indicó que mutaciones en distintos dominios de la proteína y en diferentes aminoácidos producen fenotipos diferentes. Uso de compuestos para tratar la laminoatía- Estudios previos in vitro han demostrado que los compuestos que revierten los defectos en la morfología circular causadas por mutaciones en el gen LMNA tienen un efecto beneficioso. Con el objetivo de revertir el fenotipo patológico de las mutaciónes en LamC en Drosophila, estamos evaluando el efecto de diferentes compuestos químicos. El tratamiento revierte parcialmente el fenotipo observado en moscas con la mutación LamC, pero no fue capaz de recuperar la morfología circular del núcleo. Los resultados obtenidos hasta el momento nos muestran el potencial de estos tratamientos como estrategia terapéutica para la Distrofia Muscular Congénita asociada a LMNA.
Uso de terapia génica- Una de las propuestas para tratar a los pacientes con Distrofia Muscular Congénita asociada a LMNA es el uso de terapia génica para sustituir los genes mutados por sus formas no mutadas. Estas estrategias traen implícita la duda de si los fenotipos son reversibles o no. Para determinar la evolución de los músculos una vez restaurada la forma silvestre de la LMNA, hemos diseñado un proyecto en el que induciremos la expresión de formas mutadas de LMNA usando el sistema binario de expresión Gal4/UAS, y a diferentes momentos de la enfermedad revertiremos genéticamente la expresión LMNA mutada. Nos proponemos evaluar el efecto de esta reversión, y determinar si hay un punto de no retorno o, por el contrario, la distrofia muscular es reversible fenotípicamente, y funcionalmente. Síndrome de Leigh (MIM#250620) Desde 2020 colaboro con la asociación “Todos con Hugo” para el estudio de la Neurodegeneración por deficiencia en 3-hidroxisobutiril-CoA-hidrolasa. Hugo es el único paciente en España de un total de 12 pacientes en todo el mundo. Esta mutación afecta al metabolismo del aminoácido Valina y causa deterioro neurológico y muscular. Nosotros hemos generado un modelo en Drosophila melanogaster de falta de expresión que produce atrofia muscular, deterioro neurológico y muerte prematura. Este modelo es esencial para realizar un cribado de compuestos supresores y así buscar posibles soluciones.
Repositorio de modelos de Drosophila para enfermedades raras no diagnosticadas El IIER dispone de una base de datos de casos de pacientes con enfermedades raras no diagnosticadas. Entre los datos disponibles, se han secuenciado las muestras de estos pacientes y se conocen los genes afectados en cada caso y las mutaciones concretas. Dentro de las líneas futuras de mi laboratorio se encuentra la creación de un repositorio de Drosophila que incluya las líneas transgénicas de cada uno de los genes de esta base de datos con el fin de estudiar in vivo el efecto de estas mutaciones, y generar modelos animales para estas enfermedades. El tejido nervioso y muscular están muy conservados desde Drosophila hasta humanos y representan dos de los tejidos más afectados en las enfermedades raras.
El Programa de Enfermedades Raras sin diagnostico – SpainUDP se desarrolla desde el Instituto de Investigación de Enfermedades Raras (IIER), perteneciente al ISCIII.
Dicho Programa intenta dar respuesta al elevado número de consultas que este centro viene recibiendo desde hace años sobre casos de enfermedades raras sin diagnóstico. SpainUDP ofrece un enfoque multidisciplinario a aquellos pacientes que llevan un prolongado periodo de tiempo buscando sin éxito un diagnóstico para su enfermedad.
¿Cómo contactar para solicitar entrar en el programa?
Existen dos posibilidades de acceso a este programa:
1. Registrándose en el registro de pacientes de enfermedades raras http://registroraras.isciii.es dejando la pestaña de diagnóstico como caso sin diagnóstico
2. A través del Sistema de Información y Orientación de Enfermedades Raras de FEDER
También se puede iniciar el primer contacto a través del correo registroraras@isciii.es
Este programa se realiza bajo la estrecha colaboración con la Red Internacional de Casos sin Diagnósticos (UDNI), la federación Española de Enfermedades Raras (FEDER), la Asociación D'Genes y la Asociación Objetivo Diagnóstico, cuyo Facebook puede seguirse en este enlace https://www.facebook.com/objetivodiagnostico/
Descripción del proceso
Análisis fenotípico
Durante la primera fase del protocolo se lleva a cabo un análisis del fenotipo clínico. Para ello:
· Se solicita la información clínica disponible de cada caso y todos los documentos son cuidadosamente revisados por los profesionales del Programa. La información clínica de los pacientes se almacena de forma segura en el Registro Nacional de Enfermedades Raras, previa firma del correspondiente consentimiento informado.
· Se establece una estrecha colaboración con los servicios médicos locales que atienden a los pacientes
· Si es necesario, los pacientes admitidos en el programa son citados en consultas externas, o bien ingresados en el Hospital Universitario Puerta de Hierro de Majadahonda (Madrid) para realizar un estudio clínico detallado de dichos pacientes, así como las pruebas diagnósticas que se consideren necesarias para completar la valoración de su estado clínico
Estudios genéticos
· Durante esta fase, toda la información procedente de los estudios genéticos realizados en otros centros es analizada, llegando en caso de considerarlo necesario, a contactar con el laboratorio que ha llevado a cabo dicho estudio genético con el objetivo de validar conjuntamente tanto los hallazgos como la falta de los mismos.
· Cualquier decisión acerca de decisiones a tomar sobre repetición/comprobación de análisis ya realizados, se lleva a cabo en estrecha colaboración con la familia, pero también con sus médicos.
· Por último, si el caso lo requiere se procede a realizar un estudio del exoma completo del caso, de los padres y si lo consideramos de interés en los hermanos del caso. Para este análisis se requiere la firma de un nuevo consentimiento informado ad hoc para estudios de este tipo.
· Para la realización del exoma, se requieren muestras de sangre, muestras que se obtienen siguiendo el procedimiento estandarizado por el Biobanco Nacional de Enfermedades Raras ISCIII (BioNER), con la consiguiente firma de un consentimiento informado que permite guardar la parte de la muestra no utilizada en el diagnóstico en el propio biobanco. Estas muestras podrán ser utilizadas para comprobaciones de análisis diagnósticos y para estudios funcionales demostrativos de que la mutación(es) encontrada(s) son la causa de la enfermedad.
Fase de información
· El informe completo del exoma es enviado tanto al médico del caso como a la propia familia. Los médicos de cada caso son los que finalmente proceden a valorar los hallazgos, los discuten con el IIER, si lo consideran necesario, y son los encargados de transmitir y firmar el diagnóstico definitivo al caso o a la familia (en caso de menores o incapacitados).
· El informe genético se envía a la familia para que puedan entregarlo en caso de terceras opiniones o desplazamientos de lugar de residencia.
¿Qué pasa si el estudio del exoma no detecta ninguna mutación capaz de relacionarse con el cuadro clínico?
Aproximadamente 1 de cada dos estudios de este tipo se encuentra en esta situación, es decir, no se alcanza un diagnóstico claro. Para ello se está colaborando con la Red Internacional de Casos sin Diagnóstico http://www.udninternational.org/ y con los proyectos europeos RD-CONNECT y SOLVE-RD, recientemente aprobado precisamente para ver la manera de solucionar el diagnóstico de estas personas entre todos.
La idea es buscar casos similares en todo el mundo, a través de la compartición de datos del fenotipo clínico – debidamente mapeado con la Ontología de Fenotipo Humano – y datos de variantes genéticas candidatas. Todo este vasto proceso, que está comenzando a lanzarse muy recientemente a través de plataformas de intercambio seguras como Phenome Central, Matchmaker Exchange y desde RD-CONNECT permitirá abordar diferencias y similitudes entre casos de distinto origen, permitirán conocer mejor los mecanismos de las enfermedades complejas y facilitará el diagnóstico de muchos más casos.
Servicio de Información Telefónica para la Embarazada (SITE)
Teléfono: 91 822 24 36 (para la población general).
Horario de consultas: 9 a 15 horas (lunes a viernes)

La información que se ofrece en el SITE está especialmente dirigida a:
- Las mujeres embarazadas y sus parejas.
- Las parejas que planean una gestación.
- Los padres que han tenido previamente un hijo (o un embarazo) con algún defecto congénito.
En este servicio se puede consultar sobre el riesgo que para defectos congénitos puede implicar la exposición a cualquier factor u otros aspectos que les puedan preocupar a ese respecto (tales como: edades de los padres, tabaco, alcohol, drogas, exposiciones laborales maternas o paternas, contacto con animales domésticos, etc). Para problemas médicos o tratamientos, la consulta debe realizarla el profesional encargado del cuidado de la paciente.
En cada llamada, además se ofrece información general sobre medidas preventivas para defectos congénitos, que se envía por correo a todas aquellas personas que lo soliciten.
Servicio de Información Telefónica sobre Teratógenos Español (SITTE)
Teléfono: 91 822 24 35 (para profesionales sanitarios).
Horario de consultas: 9 a 15 horas (lunes a viernes)

Este servicio tiene una finalidad equivalente a la del SITE, pero está dirigido a profesionales de la salud. Todas las consultas sobre problemas médicos o tratamientos deben ser canalizadas a través del SITTE.
Se conoce como enfermedad rara (ER) aquella cuya prevalencia es inferior a 5 casos por cada 10.000 personas en la Comunidad Europea. El objetivo del Registro de Pacientes de Enfermedades Raras es ofrecer a los profesionales del sistema de salud, investigadores, y al colectivo de pacientes y familiares un mayor nivel de conocimiento acerca del número y distribución geográfica de las personas afectadas por ER en España. Se persigue así fomentar la investigación y aumentar la visibilidad de estas enfermedades, y favorecer la toma de decisiones para una adecuada planificación sanitaria y una correcta distribución de recursos.
El Registro de Pacientes de Enfermedades Raras tiene dos vías principales de entrada de información (casos): 1) a partir de la inclusión directa del paciente por parte del propio afectado o de un familiar o representante en https://registroraras.isciii.es/ y, 2) mediante los profesionales que incluyan la información de sus bases de datos (ya sean investigadores o sociedades médicas).

El registro se sustenta desde el punto de vista legal en la orden publicada en el B.O.E de junio de 2005, (ORDEN SCO/1730/2005, DE 31 DE MAYO), donde se establecieron los criterios de creación y funcionamiento, el lugar dónde debe estar depositada la custodia legal y la responsabilidad del mismo, y sobre su mantenimiento y ulterior desarrollo. Al mismo tiempo, este registro ha sido declarado de carácter oficial ante la Agencia Nacional de Protección de Datos, en cumplimiento de la normativa vigente relativa a la protección de datos personales con el número 2060180217.
Orientado a personas afectadas y sus familias:
Cualquier persona afectada por ER, o familiar, puede inscribirse de forma voluntaria en el Registro de Pacientes de Enfermedades Raras.
Se ofrece a los propios pacientes o tutores (en caso de niños y personas incapacitadas) la oportunidad de inscribirse en este registro a través de la página web https://registroraras.isciii.es/. Una vez validada la solicitud, se proporciona un usuario y contraseña para que la persona inscrita pueda acceder al registro, consultar información sobre su enfermedad y participar en estudios mediante cuestionarios on-line sobre: uso de medicamentos, calidad de vida, análisis de la dependencia, recursos sanitarios, etc. Además, se ofrece la posibilidad de donar muestras biológicas, por su conexión con el Biobanco Nacional de Enfermedades Raras (BioNER).
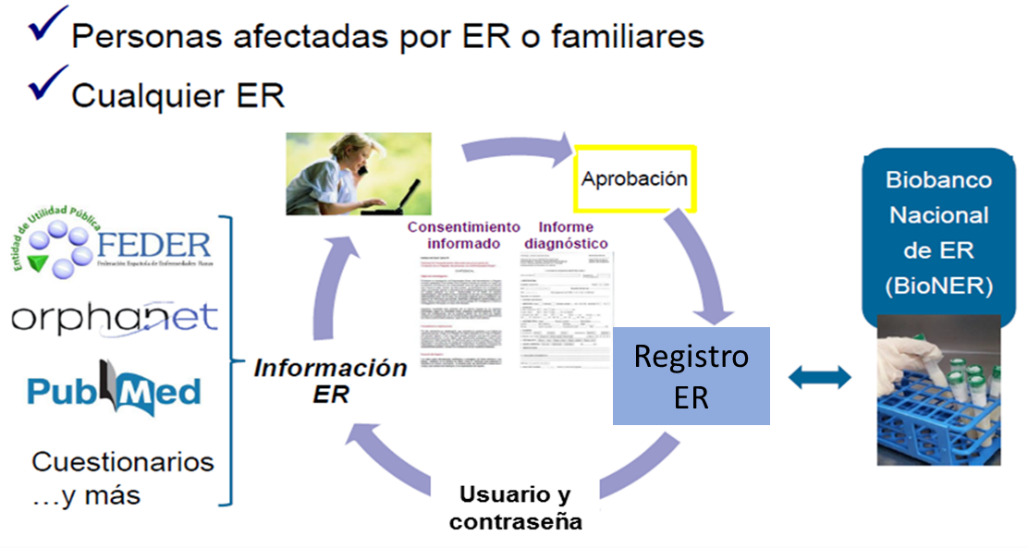
Orientado a profesionales:
Los profesionales con experiencia en alguna enfermedad rara, con registros de pacientes ya existentes o con interés en desarrollar un nuevo registro, también pueden colaborar con el Registro de Pacientes de Enfermedades Raras y unificar esfuerzos.
Los registros de pacientes que colaboran mantienen su identidad, autonomía y gestión de datos y, al tiempo que se benefician de formar parte del Registro de Enfermedades Raras, se favorece la investigación, optimizan los recursos y respetan los derechos de los ciudadanos.
La incorporación de registros de pacientes a una red de investigación conlleva VENTAJAS como la reducción de costes, promoción, difusión y menor fragmentación del número de casos.
El Registro de Pacientes de Enfermedades Raras del ISCIII surge de la red de registros SpainRDR ofreciendo posibilidades de colaboración, sin menoscabo de la identidad o autonomía de cada registro.
Procedimiento de colaboración e incorporación de registros de pacientes:
- Con cada Sociedad o Grupo de investigación se firma un Convenio de colaboración con el Instituto de Investigación de Enfermedades Raras (IIER), Instituto de Salud Carlos III
- El compromiso de los profesionales participantes se manifiesta en un Acuerdo de Consorcio
- Se define el Modelo de datos en colaboración con los responsables, manteniendo la interoperabilidad entre registros de pacientes
- Se facilita el Consentimiento informado ya evaluado y aceptado por el Comité de Ética del IIER
- El Registro de Pacientes de ER está declarado en la Agencia Española de Protección de Datos, por lo que cualquier registro que se integre en él no precisaría una declaración propia
- Se facilita el Documento de seguridad del Registro de Pacientes de ER para mantener la confidencialidad
- Autorización de Acceso al registro mediante usuario y contraseña. Existen diferentes permisos de forma que cada grupo tendrá únicamente acceso a la información de los pacientes de su registro.
Si desea iniciar una colaboración, por favor escriba a: registro.raras@isciii.es
Resultados de investigación
La unidad de Terapia Génica es un grupo de investigación que, mediante el uso de modelos murinos y celulares, así como de terapias avanzadas, trabaja en: (i) la generación de modelos celulares y animales de enfermedades raras; (ii) el estudio de los mecanismos subyacentes al desarrollo y progresión de enfermedades humanas, y (iii) la búsqueda de nuevas aproximaciones terapéuticas para su tratamiento. Hasta la fecha, la unidad se ha centrado en tres tipos de enfermedades raras: la distrofia muscular congénita asociada a LMNA, los tumores ováricos de células de la granulosa y la leucoencefalopatía agresiva de aparición temprana asociada a KARS1.
El grupo inició su actividad científica en 2016 bajo la dirección del Dr. Pérez de Castro. Desde entonces, ha establecido contratos de colaboración con fundaciones de enfermedades raras con sede en España, Estados Unidos y Bélgica (Fundación Andrés Marcio, L-CMD Research Foundation, Cure CMD, CureKARS), y ha obtenido financiación procedente de convocatorias competitivas nacionales e internacionales.
Hasta la fecha, las principales contribuciones del grupo pueden resumirse del siguiente modo:
1. Caracterización de TRMT61B como nuevo biomarcador y diana terapéutica en cánceres altamente aneuploides (Martín et al., Cell Death and Differentiation, 2022, 30(1): 37-53 (https://doi.org/10.1038/s41418-022-01044-6).
2. Estudio del potencial de la tecnología CRISPR como estrategia terapéutica frente a los tumores de células de la granulosa, causalmente asociados a la mutación FOXL2-C134W (Amarilla-Quintana et al., Molecular Oncology 2025, 19: 1092-1116 (https://doi.org/10.1002/1878-0261.13799).
3. Generación y estudio de una colección de mioblastos murinos, generados mediante CRISPR, portadores de distintas mutaciones en el gen Lmna (Gómez-Domínguez et al., Cells 2020, 9, 1286 (https://doi.org/10.3390/cells9051286).
4. Generación de un modelo de Drosophila melanogaster para la expresión de LamCR264W, que recapitula el fenotipo muscular esquelético de la L-CMD (resultados no publicados).
5. Generación de un modelo murino LmnaR249W (manuscrito en preparación), que reproduce los fenotipos cardíacos observados en la distrofia muscular humana L-CMD. Este modelo ya ha sido utilizado para evaluar el potencial de diferentes estrategias terapéuticas.
6. Reversión de características asociadas a la enfermedad mediante la integración de un minigén LMNA de tipo salvaje, utilizando la tecnología HITI, en mioblastos humanos LMNA p.R249W y en ratones LmnaR249W/R249W (Epifano et al., Human Gene Therapy, 30(11): A160-A160, 2019.).
7. Eliminación específica, mediada por CRISPR, de la mutación LMNA c.745C>T, p.R249W en fibroblastos murinos y en ratones LmnaR249W (Gómez-Domínguez et al., 2025, bioRxiv 2025.02.13.638060; doi: https://doi.org/10.1101/2025.02.13.638060; (Molecular Therapy Advances; in press).
8. Estudio del potencial terapéutico del inhibidor de p38 ARRY-797 tanto en mioblastos humanos como en modelos animales (mosca LamCR264W y ratón LmnaR249W) (Epifano et al., 2023, J Neuromuscul Dis. 2023;10(s2):S47. doi: 10.3233/JND-239001).
9. Uso de editores ABE para la corrección de la mutación LMNA c.745C>T en células humanas y murinas. Ensayos de prueba de concepto para la futura aplicación de estas aproximaciones CRISPR 2.0 en L-CMD (Santafé et al., 2026, manuscript in preparation).
10. Generación y caracterización de controles isogénicos de tipo salvaje a partir de iPSCs de L-CMD editadas mediante editores ABE (trabajo en curso).