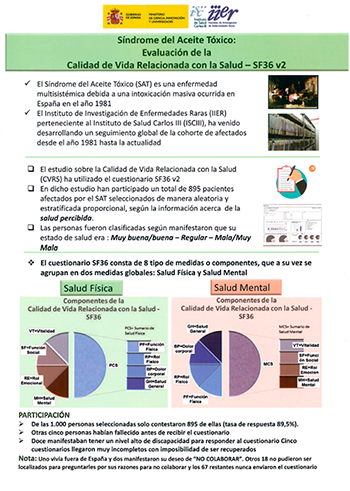
Unidad de Tumores Sólidos Infantiles
Líneas de investigación
Identificación y caracterización funcional de genes diana de la oncoproteína EWSR1::FLI1 característica de los sarcomas de Ewing
Los sarcomas de Ewing son un tipo de tumores de la infancia y la adolescencia que se caracterizan por la presencia de translocaciones cromosómicas que dan lugar a factores de transcripción quiméricos. La más frecuente de estas alteraciones cromosómicas fusiona el gen EWSR1 con el gen FLI1, dando lugar al factor de transcripción aberrante EWSR1::FLI1. EWSR1::FLI1 desempeña un papel fundamental en el desarrollo del sarcoma de Ewing, ya que regula la expresión de centenares de genes implicados en el proceso tumoral. En nuestro laboratorio combinamos el uso de tecnologías shRNA y CRISPR/Cas9 para generar modelos de enfermedad con las técnicas más avanzadas de análisis genómico y proteómico para identificar los genes implicados en el desarrollo del sarcoma de Ewing. El objetivo final es identificar genes diana que permitan el desarrollo y diseño de terapias dirigidas más eficaces y con menos efectos secundarios.
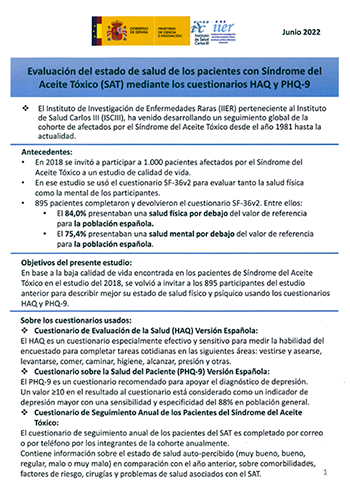
Unidad del Síndrome de Aceite Tóxico
El Síndrome del Aceite Tóxico (SAT), surgió bruscamente en España en mayo de 1981, asociándose al consumo de un aceite de colza desnaturalizado con anilina al 2% que había sido importado para usos industriales y, desviado con posterioridad al consumo humano previa refinación. Este incidente tuvo lugar en 1981 y para llevar a cabo la investigación de este nuevo síndrome se formó lo que en ese entonces se llamaría “Centro de Investigación del SAT (CISAT)”, años después se incluirían otras Enfermedades Raras (ER) dando lugar al “Centro de Investigación sobre el Síndrome del Aceite Tóxico y Enfermedades Raras (CISATER)” y finalmente quedaría integrada la estructura organizativa del actual en el Instituto de Investigación de Enfermedades Raras, plasmada en SCO/3158/2003.
Objetivos
El IIER está encargado de la investigación del SAT, tiene los siguientes objetivos:
1. Desarrollar y promover la investigación clínico-epidemiológica sobre el Síndrome del Aceite Tóxico (SAT).
2. Desarrollar y coordinar la investigación etiológica y patogénica relacionada con el origen de esta epidemia.
3. Describir la historia natural de la enfermedad conocida como Síndrome del Aceite Tóxico (SAT).
4. Custodiar y promover el registro de muestras biológicas y de aceites.
5. Asesorar a otros Organismos de la Administración, que mantienen competencias en el SAT, en aquellos aspectos relacionados con la evolución. de la enfermedad.
Líneas de Investigación
El objetivo principal de nuestro laboratorio es conocer los mecanismos implicados en la progresión de enfermedades raras y la búsqueda de posibles tratamientos. Para ello desarrollamos modelos animales en Drosophila melanogaster que reproduzcan fielmente las enfermedades humanas. Tras la validación del modelo, llevamos a cabo screenings genéticos o de compuestos aprobados por las agencias del medicamento con el objetivo de encontrar posibles dianas terapéuticas o principios activos que frenen el avance de la enfermedad.
Actualmente participamos en el programa SpainUDP con el fin de generar modelos de los casos no diagnosticados de este programa.
Además, estamos trabajando con modelos de enfermedades neurodegenerativas y tumores cerebrales de células gliales poco frecuentes que son actualmente incurables.
Descripción
Tumores cerebrales (Glioblastomas)
Estudio del efecto neurodegenerativo que causan los glioblastomas. En este proyecto describimos como el desarrollo de un glioblstoma (GB) causa una pérdida de sinapsis, y un declive cognitivo en los pacientes. Estudiamos los mecanismos de transporte vesicular implicados en el crecimiento tumoral y descubrimos el efecto beneficioso de la Brefeldina A como potencial tratamiento para proteger a las células del glioma de los cambios en el transporte vesicular.
Por otro lado, estudiamos las señales que median la comunicación entre GB y neuronas que median la progresión tumoral y la neurodegeneración. Descubrimos que las células de GB emiten unas proyecciones denominadas Tumor microtubes (TM) que facilitan la infiltración del tumor en el cerebro. Como consecuencia las células de GB roban Wg a las neuronas sanas y causa la pérdida de sinapsis y la muerte neuronal, por otro lado, las células de GB aumentan la señalización de la vía de Wg, lo que facilita la proliferación, la activación de la ruta JNK y la acumulación y secreción de MMP1.
Por último, en nuestro trabajo más reciente en este proyecto describimos como la expresión y secreción desde las células de GB de ImpL2 (Antagonista de la ruta de la insulina), causa una reducción en la señalización de la ruta de la insulina en neuronas, alteraciones mitocondriales y reducción del número de sinapsis. Estos efectos no autónomos del GB sobre la neurona, facilitan el crecimiento del tumor.
Este proyecto novedoso ha puesto de manifiesto la visión del glioblastoma como una enfermedad neurodegenerativa, y ha demostrado que la afectación neuronal juega un papel decisivo en la progresión del tumor, y en los síntomas y la muerte prematura.
Enfermedades raras:
Laminopatías (Lamina C)
En colaboración con el Dr. Ignacio Perez de Castro (IIER-ISCIII) en el desarrollo de modelos animales de laminopatía en Drosophila melanogaster. El gen LMNA en humanos codifica para las laminas A/C, que son unas proteínas de la envoltura nuclear esenciales para el mantenimiento de la integridad del núcleo. Mutaciones en este gen producen un conjunto de enfermedades conocidas como laminopatías, que incluyen varios tipos de distrofia muscular. Se ha identificado una forma mutante en heterocigosis del gen LMNA, causada por la sustitución de un aminoácido, en un paciente con Distrofia muscular Congénita asociada LMNA (L-CMD). Para evaluar si la mutación altera la función de la lamina, realizamos estudios in vivo usando Drosophila melanogaster como modelo. Esta mutación específica de la lamina C de Drosophila ha sido modelada a partir de la encontrada en el paciente y el fenotipo generado se comparó con el que causan otras mutaciones de LMNA, asociadas a la Distrofia Muscular de Emery Dreifuss Autosómica Dominante (AD-EDMD). La expresión de la mutación LamC mutada tiene un efecto dominante en el músculo de larva, produjo semi-letalidad en el estadio pupal y cambios citológicos como defectos en la morfología nuclear, agregación de la lamina C, reducción en el número de núcleos y fallos en la estructura de los sarcómeros. Los otros mutantes presentaron diferencias en el fenotipo, lo que indicó que mutaciones en distintos dominios de la proteína y en diferentes aminoácidos producen fenotipos diferentes.
Uso de compuestos para tratar la laminopatía
Estudios previos in vitro han demostrado que los compuestos que revierten los defectos en la morfología circular causadas por mutaciones en el gen LMNA tienen un efecto beneficioso. Con el objetivo de revertir el fenotipo patológico de las mutaciónes en LamC en Drosophila, estamos evaluando el efecto de diferentes compuestos químicos. El tratamiento revierte parcialmente el fenotipo observado en moscas con la mutación LamC, pero no fue capaz de recuperar la morfología circular del núcleo. Los resultados obtenidos hasta el momento nos muestran el potencial de estos tratamientos como estrategia terapéutica para la Distrofia Muscular Congénita asociada a LMNA.
Uso de terapia génica
Una de las propuestas para tratar a los pacientes con Distrofia Muscular Congénita asociada a LMNA es el uso de terapia génica para sustituir los genes mutados por sus formas no mutadas. Estas estrategias traen implícita la duda de si los fenotipos son reversibles o no. Para determinar la evolución de los músculos una vez restaurada la forma silvestre de la LMNA, hemos diseñado un proyecto en el que induciremos la expresión de formas mutadas de LMNA usando el sistema binario de expresión Gal4/UAS, y a diferentes momentos de la enfermedad revertiremos genéticamente la expresión LMNA mutada. Nos proponemos evaluar el efecto de esta reversión, y determinar si hay un punto de no retorno o, por el contrario, la distrofia muscular es reversible fenotípicamente, y funcionalmente.
Síndrome de Leigh (MIM#250620)
Desde 2020 colaboro con la asociación “Todos con Hugo” para el estudio de la Neurodegeneración por deficiencia en 3-hidroxisobutiril-CoA-hidrolasa. Hugo es el único paciente en España de un total de 12 pacientes en todo el mundo. Esta mutación afecta al metabolismo del aminoácido Valina y causa deterioro neurológico y muscular. Nosotros hemos generado un modelo en Drosophila melanogaster de falta de expresión que produce atrofia muscular, deterioro neurológico y muerte prematura. Este modelo es esencial para realizar un cribado de compuestos supresores y así buscar posibles soluciones.
Repositorio de modelos de Drosophila para enfermedades raras no diagnosticadas
El IIER dispone de una base de datos de casos de pacientes con enfermedades raras no diagnosticadas. Entre los datos disponibles, se han secuenciado las muestras de estos pacientes y se conocen los genes afectados en cada caso y las mutaciones concretas. Dentro de las líneas futuras de mi laboratorio se encuentra la creación de un repositorio de Drosophila que incluya las líneas transgénicas de cada uno de los genes de esta base de datos con el fin de estudiar in vivo el efecto de estas mutaciones, y generar modelos animales para estas enfermedades.
El tejido nervioso y muscular están muy conservados desde Drosophila hasta humanos y representan dos de los tejidos más afectados en las enfermedades raras.
1. cambios heredables causador por estrés en el desarrollo y la progresión de enfermedades. PID2022-139786OB-I00. MICINN. Instituto de Investigación de Enfermedades Raras (ISCIII). 2024-2026.
2. Estudio in vivo de tumores cerebrales pediátricos en Drosophila. PI22CIII/00062. MICINN. Instituto de Investigación de Enfermedades Raras (ISCIII). 2023-2025.
3. Cribado de supresores para el Glioma Pontino Intrínseco Difuso (DIPG) en Drosophila. Fundación Unidos contra el DIPG.
4. Generación de un modelo de Drosophila para mutaciones de HIBCH en el síndrome de Leigh. Fundación “Todos con Hugo”.
5. Estudio in vivo de tumores cerebrales en Drosophila.
Unidad de Investigación en Modelos y Mecanismos
Las principales Líneas de Investigación llevadas a cabo son:
• Generación de modelos celulares, principalmente líneas celulares pluripotentes inducidas (iPSC), para el diagnóstico y estudio de enfermedades raras.
• Estudio de mecanismos epigenéticos implicados en enfermedades raras
• Desarrollo de perfiles transcripcionales y epigenéticos para el diagnóstico de enfermedades raras en colaboración con el programa de casos sin diagnóstico SpainUDP del ISCIII
PROYECTOS:
Proyecto "Modelos y mecanismos de enfermedades ultrararas con base epigenética". Proyecto PID2021-128087OB-I00 financiado por MCIN /AEI /10.13039/501100011033 / FEDER, UE financiado por el Ministerio de Ciencia e Innovación
Proyecto "Optimización de terapias antisentido en un modelo neuronal de Síndrome de Kleefstra" financiado por la Fundación Inocente, Inocente y la Fundación Kleefstra España
Proyecto "Plaforma ISCIII de Biomodelos y Biobancos" financiado por el ISCIII
Unidad de Epigenética y Regulación Génica
Regulación epigenética de la identidad el músculo estriado y su implicación en enfermedades raras del tipo de las miopatías idiopáticas y problemas de conducción cardiaca, tales como la fibrilación atrial y el bloqueo atrioventricular. Ensayos Funcionales de Nuevas Mutaciones en Enfermos no Diagnosticados
Terapias Farmacológicas
Análisis de las alteraciones del sistema inmune presentes en las enfermedades raras.
- Estudio e identificación de nuevos reguladores de los procesos inflamatorios,
- (Papel de la inflamación y la polarización de los macrófagos en la patogénesis de las enfermedades pulmonares intersticiales difusas (EPID).
- (Establecer modelos animales para el estudio de los mecanismos implicados en las EPIDs. Diseño e identificación de nuevos agentes terapéuticos a partir de productos naturales.
- Diseño y síntesis de nuevos agentes terapéuticos.
- Estudio de los mecanismos de acción.
- Estudios toxicológicos.
- Nuevas formulaciones y liberación selectiva en órganos y tejidos.
Terapia Génica
Las principales líneas de investigación llevadas a cabo por el grupo son:
1. Uso de técnicas de editado génico basadas en el sistema CRISPR/Cas para el tratamiento de enfermedades raras y tumores huérfanos.
2. Estudio integral de la inestabilidad cromosómica y el cáncer mediante el análisis de modelos y la búsqueda de marcadores pronóstico y nuevas estrategias terapéuticas.
En la actualidad centramos nuestros esfuerzos en el estudio de dos enfermedades raras: la distrofia muscular congénita asociada a LMNA y los tumores de ovario de células de la granulosa.
Contamos con la siguiente financiación:
PROYECTO: Estudio del potencial de terapias avanzadas basadas en CRISPR/Cas y células progenitoras mesenquimales para el tratamiento de distrofias musculares congénitas asociadas a LMNA. ENTIDAD FINANCIADORA: Fundación Andrés Marcio, niños contra la laminopatía. IP: Ignacio Pérez de Castro. Duración: 2019-2024. Cuantía: 150000€.
PROYECTO: Study of the potential of CRISPR/cas Technology for the treatment of cardiac abnormalities associated with LMNA-related congenital muscular distrophy. ENTIDAD FINANCIADORA: Cure CMD. IP: Ignacio Pérez de Castro. Duración: 2023-2024. Cuantía: $50000.
PROYECTO: Distrofias congénitas asociadas a LMNA. ENTIDAD FINANCIADORA: LCMD-Research Foundation. IP: Ignacio Pérez de Castro. Duración: 2023-24. Cuantía: 29500€.
PROYECTO: Evolución de estrategias terapéuticas basadas en CRISPR/Cas con potencial para el tratamiento de la distrofia muscular congénita asociada a LMNA (PI23CIII/00041). ENTIDAD FINANCIADORA: Acción Estratégica en Salud Intramural ISCIII 2023. IP: Ignacio Pérez de Castro. Duración: 2023-25. Cuantía: 138000€.
PROYECTO: La vía de los glucocorticoides en la distrofia muscular congénita relacionada con LMNA: Descifrando mecanismos y probando estrategias terapéuticas (PID2023-147678OB-I00). ENTIDAD FINANCIADORA: Proyectos Generación de Conocimiento AEI (2023). IP: Ignacio Pérez de Castro. Duración: 2024-26. Cuantía: 275000€.
El denominado CIAC (Centro de Investigación sobre Anomalías Congénitas) es un centro asociado del Instituto de Salud Carlos III (ISCIII), que tiene carácter de Unidad, para la investigación sobre ese amplio grupo de patologías, la mayoría enfermedades raras.
Dicha Unidad fue creada el 13 de febrero de 2002, tras firmarse un convenio de colaboración entre el ISCIII y la Universidad Complutense de Madrid, a la que se encontraba vinculada la Prof. Martínez-Frías, quien trasladó su grupo de investigación (Estudio Colaborativo Español de Malformaciones Congénitas-ECEMC) al ISCIII. En la ORDEN SCO/3158/2003, de 7 de noviembre, por la que se crea el Instituto de Investigación de Enfermedades Raras (IIER), se especifica que el IIER asume la coordinación técnica con esta Unidad.
El área de estudio desarrollada en la UIAC son las anomalías congénitas, que en su inmensa mayoría son Enfermedades Raras (ER). La particularidad de estas ER es que están presentes desde el momento del nacimiento, lo que implica que las personas afectadas van a tener que enfrentarse desde tan temprana edad a sus consecuencias (muchas de ellas sin posibilidades terapéuticas), que con frecuencia originan una dependencia crónica y una disminución considerable de la calidad de vida, tanto para la persona afectada como para su entorno más cercano. Muchas de ellas, además, incrementan sustancialmente la morbilidad y el riesgo de muerte precoz. Por consiguiente, la investigación sobre este tipo de patologías, que tanto impacto pueden tener sobre la vida de la persona (y su familia), tiene un gran interés dentro del área de las ER.
Para ello, llevamos a cabo una serie de Líneas de Investigación:
1. Investigación sobre los aspectos epidemiológicos (tanto descriptivos como analíticos y clínico-epidemiológicos) de niños recién nacidos con malformaciones y otros defectos congénitos. Investigación para la identificación y caracterización de factores teratogénicos en el ser humano.
2. Identificación de causas ambientales de los defectos congénitos en niños recién nacidos.
3. Investigación sobre los aspectos clínicos, genético-clínicos, dismorfológicos y patogénicos de los defectos congénitos. Investigación citogenética y genético-molecular de niños que nacen con malformaciones y otros defectos congénitos
El objetivo principal es la identificación de las causas de los defectos congénitos (DC) para favorecer la prevención primaria de este importante grupo de enfermedades raras, y que los niños nazcan sanos.
Objetivos específicos:
─ Investigar las causas (genéticas o ambientales) de los DC, en base al registro del ECEMC (Estudio Colaborativo Español de Malformaciones Congénitas).
─ Identificar teratógenos, factores de riesgo y medidas preventivas para estas patologías.
─Traslación de los resultados de investigación a los profesionales que pueden aplicarlos, especialmente para la prevención.
─ Contribuir a la formación (de profesionales sanitarios), información (a la población general) y difusión sobre DC y su prevención.
Proyectos financiados
PROYECTO: EUROCAT Joint Action
IP: H. Dolk, Reino Unido - ML Martínez Frías y Eva Bermejo en el ISCIII
Agencia financiadora: Executive Agency for Health and Consumers. EU Health Programme 2008-2013
Duración (periodo de financiación): 2011-2013
Expediente contrato/proyecto: Ref. 2010 22 04
El área de investigación “Epidemiología de las Enfermedades Raras" del Instituto de Investigación de Enfermedades Raras (IIER) forma parte de distintas redes de investigación nacionales e internacionales y participa diversos proyectos de investigación tanto nacionales como europeos o internacionales. Cabe destacar su participación como grupo investigador en el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) y en la red de Biobancos del ISCIII (BioNER).
Objetivos
Los objetivos del grupo de “Epidemiología de las Enfermedades Raras" son los siguientes:
- Identificar la magnitud de las enfermedades raras, estableciendo un sistema de información de base epidemiológica.
- Promover la investigación clínica, básica, sociosanitaria y socieconómica de las enfermedades raras dentro del Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica (I+D+I).
- Elaborar y actualizar periódicamente un censo de los recursos de actividades en relación con las enfermedades raras.
- Impulsar y coordinar un banco de material biológico vinculado a las enfermedades raras. Impulsar la investigación relativa a las enfermedades raras en colaboración con los servicios de salud del Sistema Nacional de Salud.
- Procurar que se asegure una adecuada atención sanitaria a los pacientes con enfermedades raras en colaboración con los servicios de salud de las Comunidades Autónomas, y los coordinadores de las Redes de Investigación que sustenta el Instituto de Investigación de Enfermedades Raras.
- Promover acciones piloto de innovación en relación con la atención clínica y sociosanitaria en enfermedades raras, creando grupos de expertos que establezcan criterios de actuación, contribuyendo a elaborar protocolos clínico-terapéuticos de consenso.
- Investigar sobre las últimas causas y la patogenia del Síndrome del Aceite Tóxico.
- Impulsar la atención sanitaria de calidad y especializada de los enfermos del Síndrome del Aceite Tóxico.
Líneas de Investigación Prioritarias
Las principales líneas de investigación del grupo de “Epidemiología de las Enfermedades Raras" son:
- Epidemiología general de las Enfermedades Raras: morbilidad y mortalidad, costes sanitarios, carga de enfermedad y calidad de vida.
- Seguimiento de la cohorte de afectados por el Síndrome del Aceite Tóxico (SAT): estado de salud percibido, mortalidad, etc.
Plataformas de Apoyo a la Investigación
Además, este grupo cuenta con las siguientes Plataformas de Apoyo a la Investigación en ER:
- Registro de Pacientes de Enfermedades Raras (RePER) . y gestión del Registro Estatal de Enfermedades Raras (REER) del MSSSI (encomienda del Ministerio al IIER-ISCIII).
- Biobanco Nacional de Enfermedades Raras (BioNER).
Esta área ha desarrollado y coordina Programas de apoyo al diagnóstico como el Programa de Casos de Enfermedades Raras Sin Diagnóstico (SpainUDP) del IIER-ISCIII , en colaboración con su Área de Anomalías Congénitas (CIAC) y Área de Genética Humana (AGH-IIER Majadahonda).
Proyectos financiados
- Servidor interactivo de mortalidad debia a Enfermedades Raras en Europa: Una aproximación basada en SIG y cartografía inteligente. IP: Verónica Alonso Ferrerira. Duración:2024-2016. Referencia:
- Cambios en la carga socio-económica de la epidermolisis bullosa en Europa. IP: Verónica Alonso Ferreira. Duración: 2022-2024. Referencia: AC21CIII_2/00002.
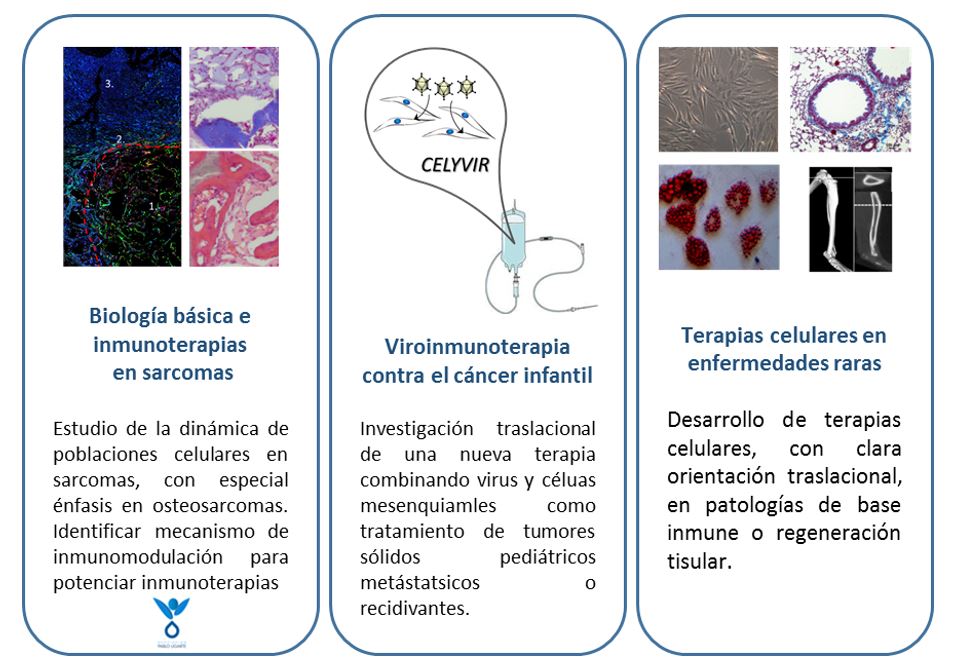
Desarrollo de terapias avanzadas para el tratamiento del sarcoma de Ewing
El tratamiento estandar del sarcoma de Ewing se basa en el uso de quimioterapia, radioterapia y cirugía. Aunque estos tratamientos son relativamente eficaces para algunos tumores localizados, son totalmente ineficientes en el caso de pacientes con tumores metastásicos o resistentes a los tratamientos convencionales. Como consecuencia de la falta de alternativas terapéuticas eficaces, tres de cada cuatro niños o adolescentes con tumores metastásicos o refractarios morirán por causa de la enfermedad. Es por tanto urgente desarrollar nuevas terapias para dar respuesta a este grupo de pacientes. En nuestro laboratorio estamos trabajando en el desarrollo de terapias disruptivas, que representen un enfoque totalmente novedoso para el tratamiento de esta enfermedad. Nuestra apuesta se basa en el uso de aproximaciones de terapia génica y el uso de vectores virales (principalmente adenovirus) y no virales (principalmente nanopartículas lipídicas) para vehiculizar las terapias a las células tumorales.
Genética Molecular
LINEAS DE INVESTIGACIÓN
- Nuevos modelos de organoides para la Investigación de enfermedades raras y sus aplicaciones biomédicas.
- Mecanismos moleculares del Déficit de alfa-1 antitripsina y su papel em la enfermedad pulmonar y hepática.
- Identificación de genes modificadores en el Déficit de Alfa-1 Antitripsina. Biomarcadores de susceptibilidad adesarrollar enfermedad hepática o pulmonar.
- Regulación del gen SERPINA1 y su papel en el Déficit de Alfa-1 Antitripsina.
- Investigación del Déficit de Esfingomielinasa Ácida tipo B (ASMD-B) y generación de biomodelos de enfermedad para el estudio de nuevas terapias
- Investigación de nuevas terapias para la fibrosis pulmonar idiopática.
PROYECTOS
1. Desarrollo de organoides pulmonares alveolares y caracterización de la función pulmonar en modelos de ratón como nuevos modelos in vitro e in vivo para ensayar nuevas terapias. Proyectos de Investigación SEPAR, Proyecto 1538. 01/06/2024-31/12/2026. IP: Beatriz Martinez Delgado. 18.000 euros.
2. Ayudas Atracción de Talento Investigador “César Nombela”. CAM. Carlos Benítez Buelga. Development of an ex vivo pulmonary fibrosis platform for identifying personalized therapies. 2023-T1/SAL-GL-29292. Contrato + Proyecto (178.780 €).
3. Plataforma de Biobancos y Biomodelos para Enfermedades raras y ultra-raras – Unidad BB-IIER. Plataformas ISCIII de apoyo a la I+D+I en biomedicina y ciencias de la salud. PT-23. PT23CIII/00003. IP:Beatriz Martinez Delgado. (Instituto de Investigación de Enfermedades Raras). 01/01/2024-31/12/2026. (144.000 €).
4. Identificación de variantes genéticas modificadoras del déficit de alfa-1 antitripsina mediante secuenciación masiva de exomas. Proyectos de Investigación SEPAR, Proyecto 1114. 01/01/2021-31/12/2022. IP: Beatriz Martinez Delgado. 18.000 euros.
5. Organoides de hígado para el estudio del Déficit de Alfa-1 Antitripsina. De las fases iniciales de la enfermedad a una estrategia terapéutica de edición génica. Proyectos de Investigación en Salud. AESI PI20CIII/00015. IP: Beatriz Martínez Delgado. (Instituto de Salud Carlos III). 01/01/2021-31/12/2023. 150.000 €.
6. Plataforma Biobancos y Biomodelos-Organoides del Instituto de Investigación de Enfermedades Raras. PT-20. Plataformas ISCIII de apoyo a la I+D+I en biomedicina y ciencias de la salud. PT20CIII/00009. IP:Beatriz Martinez Delgado. (Instituto de Investigación de Enfermedades Raras). 01/01/2021-31/12/2023. 111.000 €.
7. Identificación de factores genéticos modificadores en el Déficit de Alfa-1 Antitripsina, mecanismos de enfermedad hepática y desarrollo de organoides como modelo de enfermedad. Proyectos de Investigación en Salud. AESI PI17CIII/00042. Instituto de Salud Carlos III. IP: Beatriz Martinez Delgado. (Unidad de Genética Molecular, IIER,ISCIII). 01/01/2018- 31/12/2020. 112.000 €.
8. Organoid model of liver disease in alpha-1 antitrypsin deficiency. ALTA, Alpha-1 Antitrypsin Laurell's Training Award 2017. Nerea Matamala. (Unidad de Genética Molecular, IIER,ISCIII). 29/12/2017-29/12/2018. 50.000 €. Coordinador.
9. Implementación de tecnologías basadas en organoides. Biobanco y aplicaciones biomedicas. Desarrollo Tecnológico en Salud. DTS17CIII/00007. Instituto de Salud Carlos III. IP:Beatriz Martinez Delgado. (Unidad de Genética Molecular, IIER,ISCIII). 01/01/2018- 31/12/2019. 80.500 €.
Biotecnología Celular
Desarrollo de Terapias Avanzadas como CAR T, virus oncolíticos o Terapias Celulares Investigación en Cáncer Infantil. Esta línea pone su principal foco en el desarrollo de inmunoterapias, aunque también estudiamos el desarrollo y evolución de los tumores sólidos, especialmente sarcomas infantiles. Desarrollo de Terapias Celulares en Enfermedades Raras. Esta línea se basa, principalmente, en la utilización de células progenitoras mesenquimales como tratamientos en patologías de base inmune o regeneración de tejidos mesodérmicos.
Publicaciones destacadas
Loss of Serpina1 in Mice Leads to Altered Gene Expression in Inflammatory and Metabolic Pathways
Meghadri SH, Martinez-Delgado B, Ostermann L, Gomez-Mariano G, Perez-Luz S, Tumpara S, Wrenger S, DeLuca DS, Maus UA, Welte T, Janciauskiene S. Loss of Serpina1 in Mice Leads to Altered Gene Expression in Inflammatory and Metabolic Pathways. Int J Mol Sci. 2022 Sep 9;23(18).
PUBMED DOIMice inflammatory responses to inhaled aerosolized LPS: effects of various forms of human alpha1-antitrypsin
Sivaraman K, Wrenger S, Liu B, Schaudien D, Hesse C, Gomez-Mariano G, Perez-Luz S, Sewald K, DeLuca D, Wurm MJ, Pino P, Welte T, Martinez-Delgado B, Janciauskiene S. Mice inflammatory responses to inhaled aerosolized LPS: effects of various forms of human alpha1-antitrypsin. J Leukoc Biol. 2023 Jan 10;113(1):58-70.
PUBMED DOIQuantitative Lipid Profiling Reveals Major Differences between Liver Organoids with Normal Pi*M and Deficient Pi*Z Variants of Alpha-1-antitrypsin.
Pérez-Luz S, Lalchandani J, Matamala N, Barrero MJ, Gil-Martín S, Saz SR, Varona S, Monzón S, Cuesta I, Justo I, Marcacuzco A, Hierro L, Garfia C, Gomez-Mariano G, Janciauskiene S, Martínez-Delgado B. Quantitative Lipid Profiling Reveals Major Differences between Liver Organoids with Normal Pi*M and Deficient Pi*Z Variants of Alpha-1-antitrypsin. Int J Mol Sci. 2023 Aug 5;24(15).
PUBMED DOIAcid Sphingomyelinase Deficiency Type B Patient-Derived Liver Organoids Reveals Altered Lysosomal Gene Expression and Lipid Homeostasis.
Gomez-Mariano G, Perez-Luz S, Ramos-Del Saz S, Matamala N, Hernandez-SanMiguel E, Fernandez-Prieto M, Gil-Martin S, Justo I, Marcacuzco A, Martinez-Delgado B. Acid Sphingomyelinase Deficiency Type B Patient-Derived Liver Organoids Reveals Altered Lysosomal Gene Expression and Lipid Homeostasis.
PUBMED DOI-

-

Sergio Casas Tintó
E. Científico Titular de OPIs (A3), Jefe de Unidad
ORCID code: 0000-0002-9589-9981
-

María José Barrero Núñez
E. Científico Titular de OPIs (A3), Jefe de Unidad
ORCID code: 0000-0002-5990-7040
-
Francisco Javier Alonso García de la Rosa
Profesor de Investigación de OPIs. Jefe de grupo
ORCID code: 0000-0002-6287-8391
-

-
Saint Thomas Cervera Mayor
Investigador predoctoral
-
-

Diana Sánchez Ponce
E. Ayudante de Investigación de OPIS I+D
-
-
-
Mario Santafé
Estudiante de doctorado
-

-

-
Silvia Méndez
Estudiante de doctorado
-
Iván Hernández-Martínez
Estudiante de doctorado
-
Déborah Gómez-Domínguez
Investigadora postdoctoral
-
-

-

-

List of staff
Información adicional
El Programa de Enfermedades Raras sin diagnostico – SpainUDP se desarrolla desde el Instituto de Investigación de Enfermedades Raras (IIER), perteneciente al ISCIII.
Dicho Programa intenta dar respuesta al elevado número de consultas que este centro viene recibiendo desde hace años sobre casos de enfermedades raras sin diagnóstico. SpainUDP ofrece un enfoque multidisciplinario a aquellos pacientes que llevan un prolongado periodo de tiempo buscando sin éxito un diagnóstico para su enfermedad.
¿Cómo contactar para solicitar entrar en el programa?
Existen dos posibilidades de acceso a este programa:
1. Registrándose en el registro de pacientes de enfermedades raras http://registroraras.isciii.es dejando la pestaña de diagnóstico como caso sin diagnóstico
2. A través del Sistema de Información y Orientación de Enfermedades Raras de FEDER
También se puede iniciar el primer contacto a través del correo registroraras@isciii.es
Este programa se realiza bajo la estrecha colaboración con la Red Internacional de Casos sin Diagnósticos (UDNI), la federación Española de Enfermedades Raras (FEDER), la Asociación D'Genes y la Asociación Objetivo Diagnóstico, cuyo Facebook puede seguirse en este enlace https://www.facebook.com/objetivodiagnostico/
Descripción del proceso
Análisis fenotípico
Durante la primera fase del protocolo se lleva a cabo un análisis del fenotipo clínico. Para ello:
· Se solicita la información clínica disponible de cada caso y todos los documentos son cuidadosamente revisados por los profesionales del Programa. La información clínica de los pacientes se almacena de forma segura en el Registro Nacional de Enfermedades Raras, previa firma del correspondiente consentimiento informado.
· Se establece una estrecha colaboración con los servicios médicos locales que atienden a los pacientes
· Si es necesario, los pacientes admitidos en el programa son citados en consultas externas, o bien ingresados en el Hospital Universitario Puerta de Hierro de Majadahonda (Madrid) para realizar un estudio clínico detallado de dichos pacientes, así como las pruebas diagnósticas que se consideren necesarias para completar la valoración de su estado clínico
Estudios genéticos
· Durante esta fase, toda la información procedente de los estudios genéticos realizados en otros centros es analizada, llegando en caso de considerarlo necesario, a contactar con el laboratorio que ha llevado a cabo dicho estudio genético con el objetivo de validar conjuntamente tanto los hallazgos como la falta de los mismos.
· Cualquier decisión acerca de decisiones a tomar sobre repetición/comprobación de análisis ya realizados, se lleva a cabo en estrecha colaboración con la familia, pero también con sus médicos.
· Por último, si el caso lo requiere se procede a realizar un estudio del exoma completo del caso, de los padres y si lo consideramos de interés en los hermanos del caso. Para este análisis se requiere la firma de un nuevo consentimiento informado ad hoc para estudios de este tipo.
· Para la realización del exoma, se requieren muestras de sangre, muestras que se obtienen siguiendo el procedimiento estandarizado por el Biobanco Nacional de Enfermedades Raras ISCIII (BioNER), con la consiguiente firma de un consentimiento informado que permite guardar la parte de la muestra no utilizada en el diagnóstico en el propio biobanco. Estas muestras podrán ser utilizadas para comprobaciones de análisis diagnósticos y para estudios funcionales demostrativos de que la mutación(es) encontrada(s) son la causa de la enfermedad.
Fase de información
· El informe completo del exoma es enviado tanto al médico del caso como a la propia familia. Los médicos de cada caso son los que finalmente proceden a valorar los hallazgos, los discuten con el IIER, si lo consideran necesario, y son los encargados de transmitir y firmar el diagnóstico definitivo al caso o a la familia (en caso de menores o incapacitados).
· El informe genético se envía a la familia para que puedan entregarlo en caso de terceras opiniones o desplazamientos de lugar de residencia.
¿Qué pasa si el estudio del exoma no detecta ninguna mutación capaz de relacionarse con el cuadro clínico?
Aproximadamente 1 de cada dos estudios de este tipo se encuentra en esta situación, es decir, no se alcanza un diagnóstico claro. Para ello se está colaborando con la Red Internacional de Casos sin Diagnóstico http://www.udninternational.org/ y con los proyectos europeos RD-CONNECT y SOLVE-RD, recientemente aprobado precisamente para ver la manera de solucionar el diagnóstico de estas personas entre todos.
La idea es buscar casos similares en todo el mundo, a través de la compartición de datos del fenotipo clínico – debidamente mapeado con la Ontología de Fenotipo Humano – y datos de variantes genéticas candidatas. Todo este vasto proceso, que está comenzando a lanzarse muy recientemente a través de plataformas de intercambio seguras como Phenome Central, Matchmaker Exchange y desde RD-CONNECT permitirá abordar diferencias y similitudes entre casos de distinto origen, permitirán conocer mejor los mecanismos de las enfermedades complejas y facilitará el diagnóstico de muchos más casos.
Servicio de Información Telefónica para la Embarazada (SITE)
Teléfono: 91 822 24 36 (para la población general).
Horario de consultas: 9 a 15 horas (lunes a viernes)

La información que se ofrece en el SITE está especialmente dirigida a:
- Las mujeres embarazadas y sus parejas.
- Las parejas que planean una gestación.
- Los padres que han tenido previamente un hijo (o un embarazo) con algún defecto congénito.
En este servicio se puede consultar sobre el riesgo que para defectos congénitos puede implicar la exposición a cualquier factor u otros aspectos que les puedan preocupar a ese respecto (tales como: edades de los padres, tabaco, alcohol, drogas, exposiciones laborales maternas o paternas, contacto con animales domésticos, etc). Para problemas médicos o tratamientos, la consulta debe realizarla el profesional encargado del cuidado de la paciente.
En cada llamada, además se ofrece información general sobre medidas preventivas para defectos congénitos, que se envía por correo a todas aquellas personas que lo soliciten.
Servicio de Información Telefónica sobre Teratógenos Español (SITTE)
Teléfono: 91 822 24 35 (para profesionales sanitarios).
Horario de consultas: 9 a 15 horas (lunes a viernes)

Este servicio tiene una finalidad equivalente a la del SITE, pero está dirigido a profesionales de la salud. Todas las consultas sobre problemas médicos o tratamientos deben ser canalizadas a través del SITTE.
Se conoce como enfermedad rara (ER) aquella cuya prevalencia es inferior a 5 casos por cada 10.000 personas en la Comunidad Europea. El objetivo del Registro de Pacientes de Enfermedades Raras es ofrecer a los profesionales del sistema de salud, investigadores, y al colectivo de pacientes y familiares un mayor nivel de conocimiento acerca del número y distribución geográfica de las personas afectadas por ER en España. Se persigue así fomentar la investigación y aumentar la visibilidad de estas enfermedades, y favorecer la toma de decisiones para una adecuada planificación sanitaria y una correcta distribución de recursos.
El Registro de Pacientes de Enfermedades Raras tiene dos vías principales de entrada de información (casos): 1) a partir de la inclusión directa del paciente por parte del propio afectado o de un familiar o representante en https://registroraras.isciii.es/ y, 2) mediante los profesionales que incluyan la información de sus bases de datos (ya sean investigadores o sociedades médicas).

El registro se sustenta desde el punto de vista legal en la orden publicada en el B.O.E de junio de 2005, (ORDEN SCO/1730/2005, DE 31 DE MAYO), donde se establecieron los criterios de creación y funcionamiento, el lugar dónde debe estar depositada la custodia legal y la responsabilidad del mismo, y sobre su mantenimiento y ulterior desarrollo. Al mismo tiempo, este registro ha sido declarado de carácter oficial ante la Agencia Nacional de Protección de Datos, en cumplimiento de la normativa vigente relativa a la protección de datos personales con el número 2060180217.
Orientado a personas afectadas y sus familias:
Cualquier persona afectada por ER, o familiar, puede inscribirse de forma voluntaria en el Registro de Pacientes de Enfermedades Raras.
Se ofrece a los propios pacientes o tutores (en caso de niños y personas incapacitadas) la oportunidad de inscribirse en este registro a través de la página web https://registroraras.isciii.es/. Una vez validada la solicitud, se proporciona un usuario y contraseña para que la persona inscrita pueda acceder al registro, consultar información sobre su enfermedad y participar en estudios mediante cuestionarios on-line sobre: uso de medicamentos, calidad de vida, análisis de la dependencia, recursos sanitarios, etc. Además, se ofrece la posibilidad de donar muestras biológicas, por su conexión con el Biobanco Nacional de Enfermedades Raras (BioNER).
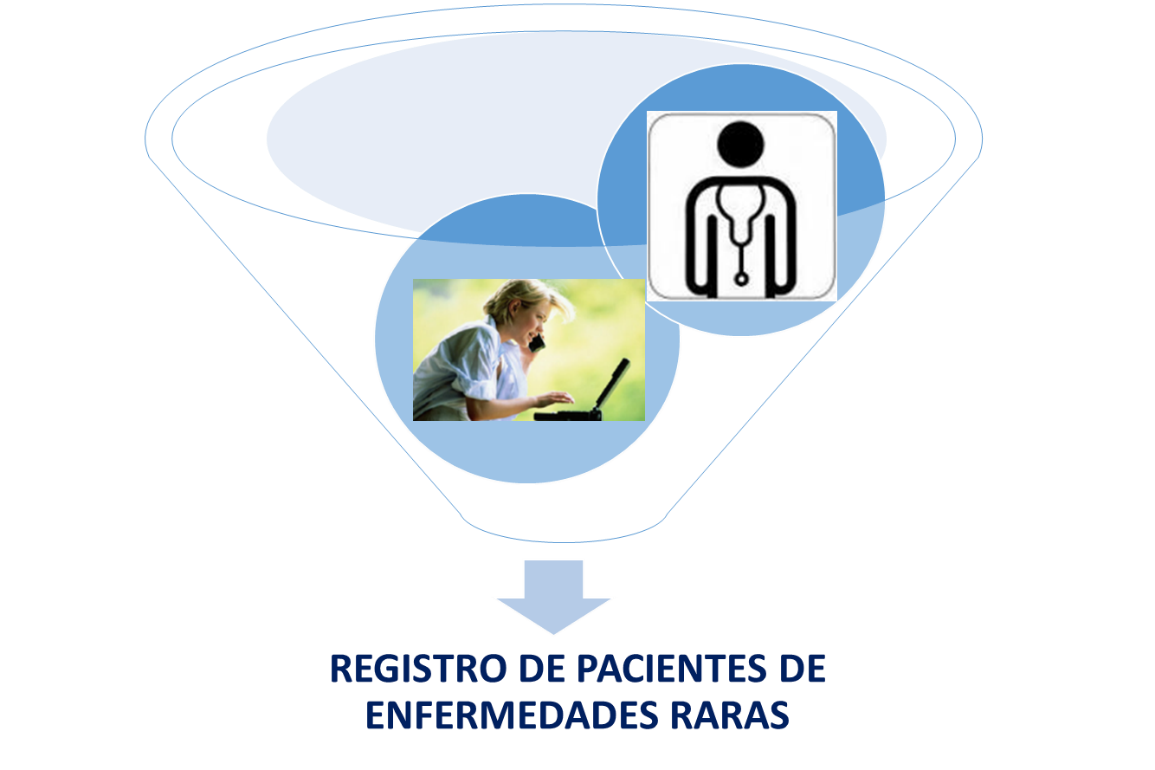
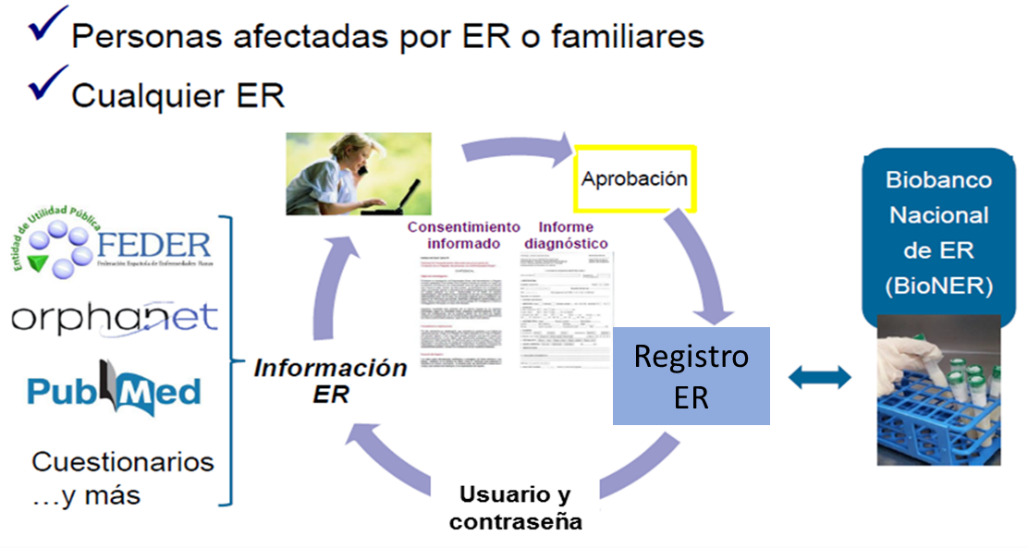
Orientado a profesionales:
Los profesionales con experiencia en alguna enfermedad rara, con registros de pacientes ya existentes o con interés en desarrollar un nuevo registro, también pueden colaborar con el Registro de Pacientes de Enfermedades Raras y unificar esfuerzos.
Los registros de pacientes que colaboran mantienen su identidad, autonomía y gestión de datos y, al tiempo que se benefician de formar parte del Registro de Enfermedades Raras, se favorece la investigación, optimizan los recursos y respetan los derechos de los ciudadanos.
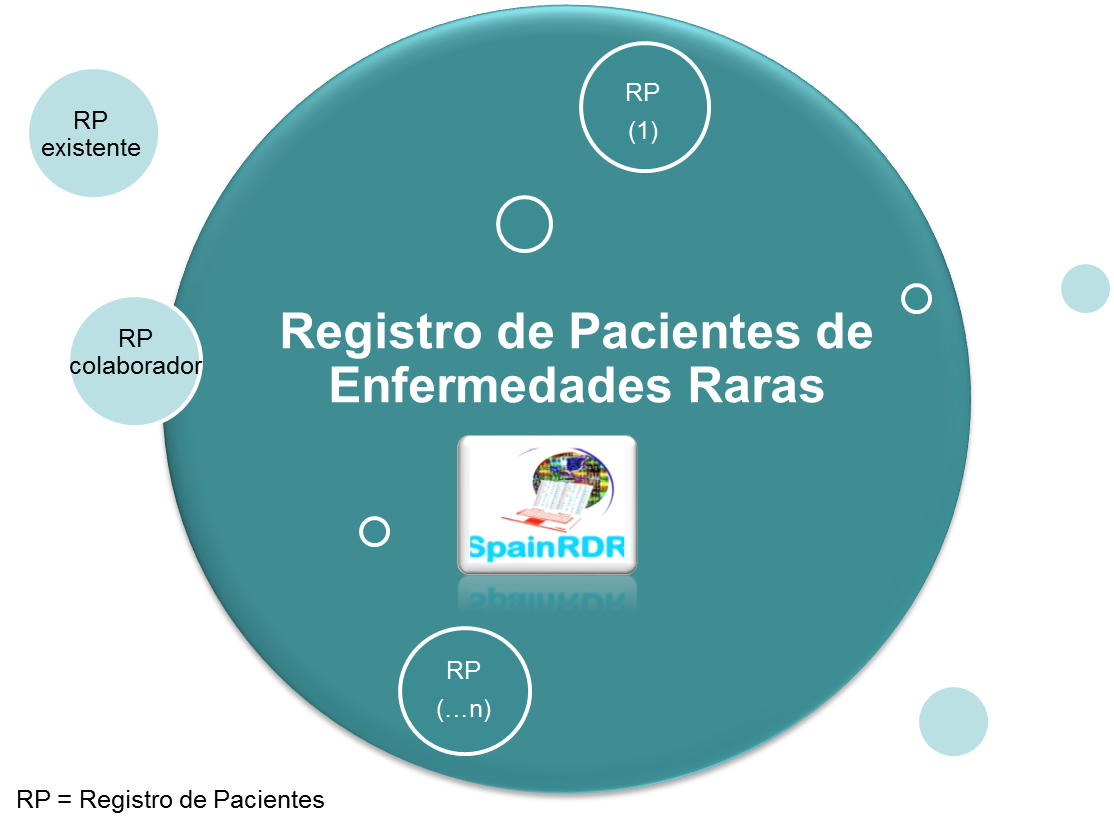
La incorporación de registros de pacientes a una red de investigación conlleva VENTAJAS como la reducción de costes, promoción, difusión y menor fragmentación del número de casos.
El Registro de Pacientes de Enfermedades Raras del ISCIII surge de la red de registros SpainRDR ofreciendo posibilidades de colaboración, sin menoscabo de la identidad o autonomía de cada registro.
Procedimiento de colaboración e incorporación de registros de pacientes:
- Con cada Sociedad o Grupo de investigación se firma un Convenio de colaboración con el Instituto de Investigación de Enfermedades Raras (IIER), Instituto de Salud Carlos III
- El compromiso de los profesionales participantes se manifiesta en un Acuerdo de Consorcio
- Se define el Modelo de datos en colaboración con los responsables, manteniendo la interoperabilidad entre registros de pacientes
- Se facilita el Consentimiento informado ya evaluado y aceptado por el Comité de Ética del IIER
- El Registro de Pacientes de ER está declarado en la Agencia Española de Protección de Datos, por lo que cualquier registro que se integre en él no precisaría una declaración propia
- Se facilita el Documento de seguridad del Registro de Pacientes de ER para mantener la confidencialidad
- Autorización de Acceso al registro mediante usuario y contraseña. Existen diferentes permisos de forma que cada grupo tendrá únicamente acceso a la información de los pacientes de su registro.
Si desea iniciar una colaboración, por favor escriba a: registro.raras@isciii.es
Publicaciones seleccionadas de los 7 últimos años:
- Pérez de Castro I, Carmena M, Prigent C, Glover DM. Editorial: Aurora Kinases: Classical Mitotic Roles, Non-Canonical Functions and Translational Views. Front Oncol. 2017 Mar 22;7:48. (A)
- Blas-Rus N, Bustos-Morán E, Pérez de Castro I, de Cárcer G, Borroto A, Camafeita E, et al. Aurora A drives early signalling and vesicle dynamics during T-cell activation. Nat Commun. 2016 Apr 19;7:11389. (A) IF:12.2
- Navarro P, Bueno MJ, Zagorac I, Mondejar T, Sanchez J, Mourón S, et al. Targeting Tumor Mitochondrial Metabolism Overcomes Resistance to Antiangiogenics. Cell Rep. 2016 Jun 21;15(12):2705–18. (A) IF:8.2
- González-Loyola A, Fernández-Miranda G, Trakala M, Partida D, Samejima K, Ogawa H, et al. Aurora B Overexpression Causes Aneuploidy and p21 Cip1 Repression during Tumor Development. Mol Cell Biol. 2015 Oct 15;35(20):3566–78. (A) IF:4.3
- Shim SY, de Castro IP, Neumayer G, Wang J, Park SK, Sanada K, et al. Phosphorylation of Targeting Protein for Xenopus Kinesin-like Protein 2 (TPX2) at Threonine 72 in Spindle Assembly. J Biol Chem. 2015 Apr 3;290(14):9122–34. (A) IF:4.1
- Moreno A, Martínez A, Olmedillas S, Bello S, de Miguel F. Efecto del ácido hialurónico sobre células madre mesenquimales derivadas de tejido adiposo. Evaluación biológica in vitro. Rev Esp Cir Ortop Traumatol. 2015 Jul;59(4):215–21. (A)
- Malumbres M, Pérez de Castro I. Aurora kinase A inhibitors: promising agents in antitumoral therapy. Expert Opin Ther Targets. 2014 Dec;18(12):1377–93. (A) IF:4.8
- Goni GM, Epifano C, Boskovic J, Camacho-Artacho M, Zhou J, Bronowska A, et al. Phosphatidylinositol 4,5-bisphosphate triggers activation of focal adhesion kinase by inducing clustering and conformational changes. Proc Natl Acad Sci. 2014 Aug 5;111(31):E3177–86. (A) IF:9.6
- Epifano C, Megias D, Perez-Moreno M. p120-catenin differentially regulates cell migration by Rho-dependent intracellular and secreted signals. EMBO Rep. 2014 May 1;15(5):592–600. (A) IF:8.5
- Piazzolla D, Palla AR, Pantoja C, Cañamero M, de Castro IP, Ortega S, et al. Lineage-restricted function of the pluripotency factor NANOG in stratified epithelia. Nat Commun. 2014 Jun 30;5. (A) IF:12.2
- Pérez de Castro I, Aguirre-Portolés C, Fernández-Miranda G, Canamero M, Cowley DO, Van Dyke T, et al. Requirements for Aurora-A in Tissue Regeneration and Tumor Development in Adult Mammals. Cancer Res. 2013 Nov 15;73(22):6804–15. (A) IF:9.1
- Shahbazi MN, Megias D, Epifano C, Akhmanova A, Gundersen GG, Fuchs E, et al. CLASP2 interacts with p120-catenin and governs microtubule dynamics at adherens junctions. J Cell Biol. 2013 Dec 23;203(6):1043–61. (A) IF:7.9
- Trakala M, Fernández-Miranda G, Pérez de Castro I, Heeschen C, Malumbres M. Aurora B prevents delayed DNA replication and premature mitotic exit by repressing p21 Cip1. Cell Cycle. 2013 Apr 28;12(7):1030–41. (A) IF:3.5
- Pérez de Castro I, Malumbres M. Mitotic Stress and Chromosomal Instability in Cancer: The Case for TPX2. Genes Cancer. 2012 Nov 1;3(11–12):721–30. (A)
- Epifano C, Pérez-Moreno M. Crossroads of integrins and cadherins in epithelia and stroma remodeling. Cell Adh Migr. 2012 May 28;6(3):261–73.
- Aguirre-Portolés C, Bird AW, Hyman A, Cañamero M, Pérez de Castro I, Malumbres M. Tpx2 controls spindle integrity, genome stability, and tumor development. Cancer Res. 2012 Mar 15;72(6):1518–28. (A) IF:9.1
- Osei-Sarfo K, Pérez de Castro I, Pellicer A. p15INK4b plays a crucial role in murine lymphoid development and tumorigenesis. Carcinogenesis. 2012 Mar 1;33(3):708–13. (A) IF:5.1
- Bueno MJ, Gómez de Cedrón M, Gómez-López G, Pérez de Castro I, Di Lisio L, Montes-Moreno S, et al. Combinatorial effects of microRNAs to suppress theMyc oncogenic pathway. Blood. 2011 Jun 9;117(23):6255–66. (A) IF:13.1
- Pérez de Castro I, Aguirre-Portolés C, Martin B, Fernández-Miranda G, Klotzbucher A, Kubbutat MHG, et al. A SUMOylation Motif in Aurora-A: Implications for Spindle Dynamics and Oncogenesis. Front Oncol. 2011 Jan;1(December):50. (A)
- Fernández-Miranda G, Trakala M, Martín J, Escobar B, González A, Ghyselinck NB, et al. Genetic disruption of aurora B uncovers an essential role for aurora C during early mammalian development. Development. 2011 Jul;138(13):2661–72. (A) IF:5.8
- Fernández-Miranda G, Pérez de Castro I, Carmena M, Aguirre-Portolés C, Ruchaud S, Fant X, et al. SUMOylation modulates the function of Aurora-B kinase. J Cell Sci. 2010 Aug 15;123(Pt 16):2823–33. (A) IF:4.4
1) Alvaro-Blanco J., Urso K., Chiodo Y., Martín-Cortázar C., Kourani O., Gómez-del Arco P., Rodríguez-Martínez M., Calonge E., Alcamí J., Redondo JM., Iglesias T., and MR. Campanero. MAZ induces MYB expression during the exit from quiescence via the E2F site in the MYB promoter. 2017. Nucleic Acids Research. 45 (17): 9960-9975.
2) Kurusamy S., López-Maderuelo D., Little R., Cadagan D., Savage A.M., Ihugba J.C., Baggott RR, Rowther FB., Martínez-Martínez S, Gómez-del Arco P., Murcott C., Wang W., Nistal F.J., Oceandy D, Neyses L, Wilkinson R.N., Cartwright EJ, Redondo J.M. and A.L. Armesilla. Selective inhibition of plasma membrane calcium ATPase4 improves angiogénesis and vascular reperfusion. 2017. J. Mol. Cell. Cardiol. 109: 38-47.
3) Gómez-del Arco P*., Perdiguero E., Yunes-Leites P.S., Acín-Pérez R., Zeini M., García-Gómez A., Sreenivasan K., Jiménez-Alcázar M., Segalés J., López-Maderuelo D., Ornés B., Jiménez-Borreguero L.J., D´Amato G., Enshell-Seijffers D., Morgan B., Georgopoulos K., Islam AbuL B.M.M.K., Braun T., de la Pompa J.L., Kim J., Enriquez J.A., Ballestar E,, Muñoz-Cánoves P. and Redondo J.M*. *corresponding authors. The Chromatin Remodeling Complex Chd4/NuRD controls striated muscle identity and metabolic homeostasis. 2016. Cell Metabolism. 23: 881-892.
4) MacGrogan D., D´Amato G., Travisano S., Martinez-Poveda B., Luxán G., del Monte-Nieto G., Papoutsi T., Sbroggio M., Bou V., Gómez-del Arco P., Gómez M.J., Zhou B., Redondo J.M., Jiménez-Borreguero L.J., de la Pompa J.L. Sequential ligand-dependent Notch signaling activation regulates valve primordium formation and morphogenesis. 2016. Circulation Research. 118 (10): 1480-1497.
5) Baggott RR, Alfranca A, López-Maderuelo D, Mohamed TM, Escolano A, Oller J, Ornes BC, Kurusamy S, Rowther FB, Brown JE, Oceandy D, Cartwright EJ, Wang W, Gómez-del Arco P, Martínez-Martínez S., Neyses L, Redondo JM, Armesilla AL. Plasma membrane calcium ATPase isoform 4 inhibits vascular endothelial growth factor-mediated angiogenesis through interaction with calcineurin. 2014. Arterioscler. Thromb. Vasc. Biol. Volumen: 34: 2310-2320.
6) Escolano A, Martínez‐Martínez S, Alfranca A, Urso K, Izquierdo HM, Delgado M, Martín F, Sabio G, Sancho D, Gómez-del Arco P, Redondo JM. Specific calcineurin targeting in macrophages confers resistance to inflammation via MKP‐1 and p38. 2014. EMBO J. 33 (10): 1117-1133.
7) Pablo Gómez-del Arco, Mariko Kashiwagi, Audrey F. Jackson, Taku Naito, Jiangwen Zhang, Feifei Liu, Barbara Kee, Marc Vooijs, Freddy Radtke, Juan Miguel Redondo and Katia Georgopoulos. Alternative promoter usage at the Notch1 locus supports ligand-independent signaling in T cell development and leukemogenesis. 2010. Immunity. 33(5): 685-698.
Publicaciones de los últimos siete años:
- Berdasco M, Gómez A, Rubio MJ, Català-Mora J, Zanón-Moreno V, Lopez M, et al. DNA Methylomes Reveal Biological Networks Involved in Human Eye Development, Functions and Associated Disorders. Sci Rep. 2017;7(1):11762. doi: 10.1038/s41598-017-12084-1.
- Katschnig AM, Kauer MO, Schwentner R, Tomazou E, Mutz CN, Linder M, et al. EWS-FLI1 perturbs MRTFB/YAP-1/TEAD target gene regulation inhibiting cytoskeletal auto-regulatory feedback in Ewing sarcoma. Oncogene. 2017:doi: 10.1038/onc.2017.202
- Schwentner R, Herrero-Martín D, Kauer MO, Mutz CN, Katschnig AM, Sienski G, et al. The role of miR-17-92 in the mi Regulatory landscape of Ewing sarcoma. Oncotarget. 2017;8(7):10980-93.
- Mutz CN, Schwentner R, Aryee DNT, Bouchard EDJ, Mejia EM, Hatch GM, et al. EWS-FLI1 confers exquisite sensitivity to NAMPT inhibition in Ewing sarcoma cells. Oncotarget. 2017;8(15):24679-93.
- Huertas-Martínez J, Court F, Rello-Varona S, Herrero-Martín D, Almacellas-Rabaiget O, Sainz-Jaspeado M, et al. DNA methylation profiling identifies PTRF/Cavin-1 as a novel tumor suppressor in Ewing sarcoma when co-expressed with caveolin-1. Cancer letters. 2017;386:196-207.
- He T, Surdez D, Rantala JK, Haapa-Paananen S, Ban J, Kauer M, et al. High-throughput RNAi screen in Ewing sarcoma cells identifies leucine rich repeats and WD repeat domain containing 1 (LRWD1) as a regulator of EWS-FLI1 driven cell viability. Gene. 2017;596:137-46.
- Cidre-Aranaz F, Grunewald TG, Surdez D, Garcia-Garcia L, Carlos Lazaro J, Kirchner T, et al. EWS-FLI1-mediated suppression of the RAS-antagonist Sprouty 1 (SPRY1) confers aggressiveness to Ewing sarcoma. Oncogene. 2017;36(6):766-76.
- Bardon-Cancho EJ, Haro-Díaz A, Alonso-Garcia-de la Rosa FJ, Huerta-Aragones J, Garcia-Morin M, González-Martinez F, et al. DICER1 mutation and tumors associated with a familial tumor predisposition syndrome: practical considerations. Fam Cancer. 2017;16(2):291-4.
- Ruiz-Pinto S, Pita G, Patino-García A, Garcia-Miguel P, Alonso J, Perez-Martinez A, et al. Identification of genetic variants in pharmacokinetic genes associated with Ewing Sarcoma treatment outcome. Annals of oncology 2016;27(9):1788-93.
- Rodriguez-Martin C, Cidre F, Fernandez-Teijeiro A, Gómez-Mariano G, de la Vega L, Ramos P, et al. Familial retinoblastoma due to intronic LINE-1 insertion causes aberrant and noncanonical mRNA splicing of the RB1 gene. J Hum Genet. 2016.
- Nieto-Soler M, Morgado-Palacín I, Lafarga V, Lecona E, Murga M, Callen E, et al. Efficacy of ATR inhibitors as single agents in Ewing sarcoma. Oncotarget. 2016;7(37):58759-67.
- Mutz CN, Schwentner R, Kauer MO, Katschnig AM, Kromp F, Aryee DN, et al. EWS-FLI1 impairs aryl hydrocarbon receptor activation by blocking tryptophan breakdown via the kynurenine pathway. FEBS letters. 2016;590(14):2063-75.
- Grünewald TGP, Bernard V, Gilardi-Hebenstreit P, Raynal V, Surdez D, Aynaud M-M, et al. Chimeric EWSR1-FLI1 regulates the Ewing sarcoma susceptibility gene EGR2 via a GGAA microsatellite. Nature Genetics. 2015;47(9):1073-+.
- Cidre-Aranaz F, Alonso J. EWS/FLI1 Target Genes and Therapeutic Opportunities in Ewing Sarcoma. Frontiers in oncology. 2015;5:162.
- Lara B, Teresa Martinez M, Blanco I, Hernandez-Moro C, Velasco EA, Ferrarotti I, et al. Severe alpha-1 antitrypsin deficiency in composite heterozygotes inheriting a new splicing mutation QOMadrid. Respiratory Research. 2014;15:125
- Agra N, Cidre F, Garcia-Garcia L, de la Parra J, Alonso J. Lysyl Oxidase Is Downregulated by the EWS/FLI1 Oncoprotein and Its Propeptide Domain Displays Tumor Supressor Activities in Ewing Sarcoma Cells. Plos One. 2013;8(6).
- Postel-Vinay S, Veron AS, Tirode F, Pierron G, Reynaud S, Kovar H, et al. Common variants near TARDBP and EGR2 are associated with susceptibility to Ewing sarcoma. Nat Genet. 2012;44(3):323-7.
- Kovar H, Alonso J, Aman P, Aryee DN, Ban J, Burchill SA, et al. The first European interdisciplinary ewing sarcoma research summit. Front Oncol. 2012;2:54.
- Serrano C, Alonso J, Gómez-Mariano G, Aguirre E, Diéz O, Gadea N, et al. Low penetrance hereditary retinoblastoma in a family: what should we consider in the genetic counselling process and follow up?. Familial Cancer. 2011;10:617-621.
- Kontic M, Palacios I, Kontic M, Alonso J, Pestaña A. Linkage analysis and detection of somatic, postzygous RB1 mutations in Serbian retinoblastoma patients. Journal of BUON. 2011;16:142-146.
- Lalli E., Alonso J. Targeting DAX-1 in embryonic stem cells and cancer. Expert Opin. Ther. Targets. 2010;14:169-177
- Navarro D, Agra N, Pestaña A, Alonso J, González-Sancho J. The EWS/FLI1 oncogenic protein inhibits expression of the Wnt inhibitor DICKKOPF-1 gene and antagonizes β-catenin/TCF-mediated transcription. Carcinogenesis. 2010;3:394-401.
- Gómez-Cabello D, Callejas S, Benguría A, Moreno A, Alonso J, Palmero I. Regulation of the microRNA processor DGCR8 by the tumor suppressor ING1. Cancer Res. 2010;70(5):1866-74.
Publicaciones de los últimos siete años:
- Rincón E, Cejalvo T, Kanojia D, Alfranca A, Rodríguez-Milla MÁ, Hoyos RAG, Han Y, Zhang L, Alemany R, Lesniak MS, García-Castro J. Mesenchymal stem cell carriers enhance antitumor efficacy of oncolytic adenoviruses in an immunocompetent mouse model. Oncotarget. 2017. 8 (28):45415-45431. (A). (A). IF: 6,35.
- Moreno R, Rojas LA, Villellas FV, Soriano VC, García-Castro J, Fajardo CA, Alemany R. Human Menstrual Blood-Derived Mesenchymal Stem Cells as Potential Cell Carriers for Oncolytic Adenovirus. Stem Cells Int. 2017; 3615729. (A). IF: 3,54.
- Macia A, Widmann TJ, Heras S1, Ayllon V, Sanchez L, Benkaddour-Boumzaouad M, Munoz-Lopez M, Rubio A, Amador-Cubero S, Blanco-Jimenez E, Garcia-Castro J, Menendez P, Ng P, Muotri AR, Goodier JL, Garcia-Perez JL. Engineered LINE-1 retrotransposition in non-dividing human neurons. Genome Res. 2017, 27(3):335-348. (A). IF: 11,35.
- Almazán-Moga A, Zarzosa P, Vidal I, Molist C, Giralt I, Navarro N, Soriano A, Segura MF, Alfranca A, Garcia-Castro J, Sánchez de Toledo J, Roma J, Gallego S. Hedgehog Pathway Inhibition Hampers Sphere and Holoclone Formation in Rhabdomyosarcoma. Stem Cells Int. 2017. 7507380. (A). IF: 3,54.
- Toraño EG, Bayón GF, Del Real Á, Sierra MI, García MG, Carella A, Belmonte T, Urdinguio RG, Cubillo I, García-Castro J, Delgado-Calle J, Pérez-Campo FM, Riancho JA, Fraga MF, Fernández AF. Age-associated hydroxymethylation in human bone-marrow mesenchymal stem cells. J Transl Med. 2016, 14(1):207. (A). IF: 3,99.
- Abarrategi A, Tornin J, Martinez-Cruzado L, Hamilton A, Martinez-Campos E, Rodrigo JP, González MV, Baldini N, Garcia-Castro J, Rodriguez R. Osteosarcoma: Cells-of-Origin, Cancer Stem Cells, and Targeted Therapies. Stem Cells Int. 2016, 2016:3631764. (R). IF: 3,54.
- Martinez-Cruzado L, Tornin J, Santos L, Rodriguez A, García-Castro J, Morís F, Rodriguez R. Aldh1 Expression and Activity Increase During Tumor Evolution in Sarcoma Cancer Stem Cell Populations. Sci Rep. 2016, 6:27878. (A). IF: 5,228.
- Melen GJ, Franco L, Ruano D, González-Murillo Á, Alfranca A, Casco F, Lassaletta Á, Alonso M, Madero L, Alemany R, García-Castro J, Ramírez M. Influence of carrier cells on the clinical outcome of children with neuroblastoma treated with high dose of oncolytic adenovirus delivered in mesenchymal stem cells. Cancer letters 2016, 371, 2; 161-170. (A). IF: 5,62.
- Ramírez M, García-Castro J, Melen GJ, González-Murillo Á, Franco-Luzón L. Patient-derived mesenchymal stem cells as delivery vehicles for oncolytic virotherapy: novel state-of-the-art technology. Oncolytic Virother. 2015, Oct 14; 4:149-55. (R).
- Marina Martinez-Carmona, Alejandro Baeza, Miguel Angel Rodriguez-Milla, Javier García-Castro, Maria Vallet. Mesoporous silica nanoparticles grafted with light-responsive protein shell for highly cytotoxic antitumoral therapy. J. Mater. Chem. B 2015, 3: 5746-5752. (A). IF: 4,54
- Arantzazu Alfranca*, Lucia Martinez-Cruzado*, Juan Tornin*, Ander Abarrategi, Teresa Amaral, Enrique de Álava, Pablo Menéndez, Javier Garcia-Castro and Rene Rodriguez. Bone microenvironment signals in osteosarcoma development. Cellular and Molecular Life Sciences 2015, 72(16):3097-113. (R). IF: 5,85.
- Ana Entrena, Alberto Varas, Miriam Vázquez, Gustavo J Melen, Lidia M Fernández-Sevilla, Javier García-Castro, Manuel Ramírez, Agustín G. Zapata, Ángeles Vicente. Mesenchymal stem cells derived from low risk acute lymphoblastic leukemia patients promote NK cell antitumor activity. Cancer Letters 2015, 28; 363(2):156-65. (A). IF: 5,01.
- Agustín F. Fernandez, Gustavo F. Bayón, Rocío G. Urdinguio, Estela G. Toraño, Sandra Petrus, Cecilia Ferrero, Pablo Martinez-Camblor, Isabel Cubillo, Javier García-Castro, Jesús Delgado-Calle, José A. Riancho, Corrado Fagnani, Emanuela Medda, Virgilia Toccaceli, Sebastián Moran, Manel Esteller, Lorenza Nistico, María A. Stazi, Mario F. Fraga. H3K4me1 marks regions hypomethylated during aging in human stem and differentiated cells. Genome Research 2015, 25(1):27-40. (A). IF: 13,85.
- Cussó L, Mirones I, Peña-Zalbidea S, García-Vázquez V, García-Castro J, Desco M. Combination of Single-Photon Emission Computed Tomography and Magnetic Resonance Imaging to Track 111In-Oxine-Labeled Human Mesenchymal Stem Cells in Neuroblastoma-Bearing Mice. Molecular Imaging 2014, 13(10): 7290201400033. (A). IF: 2,19.
- Isabel Mirones, Miguel Ángel Rodríguez*, Isabel Cubillo, Luis Mariñas-Pardo, Teresa de la Cueva, Agustín Zapata, Carlos González, Manuel Ramírez, Javier García-Castro. Dopamine mobilizes mesenchymal progenitor cells into peripheral blood through D2-class receptors and their PI3K/AKT pathway. Stem Cells 2014, 32(9):2529-38. (A). IF: 7,74.
- Luis Antonio Mariñas-Pardo, Isabel Mirones-Aguilar, Oscar Amor-Carro, Rebeca Fraga-Iriso, Beatriz Lema-Costa, Isabel Cubillo-Moreno, Miguel Angel-Rodriguez Milla, Javier García-Castro*, David Ramos-Barbón*. Adipose-derived mesenchymal stem cells regulate airway contractile tissue remodeling in experimental asthma. Allergy 2014, 69 (6):730-40. (A). IF: 5,88.
- R Rubio*, A Abarrategi*, J Garcia-Castro*, L Martinez-Cruzado, C Suarez, J Tornin, L Santos, A Astudillo, I Colmenero, F Mulero, M Rosu-Myles, P Menendez, R Rodriguez. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells 2014, 32:1136–1148. (A). IF: 7,74.
- Á Vicente López, MN Vázquez García, GJ Melen, A Entrena Martínez, I Cubillo Moreno, J García-Castro, M Ramírez Orellana, AG Zapata González. Mesenchymal stromal cells derived from the bone marrow of acute lymphoblastic leukemia patients show altered BMP4 production: Correlations with the course of disease. Plos ONE 2014, 9(1):e84496. (A). IF: 4,41.
- Abarrategi A, Perez-Tavarez R, Rodriguez-Milla MA, Cubillo I, Mulero F, Alfranca A, Lopez-Lacomba JL, García-Castro J. In Vivo Ectopic Implantation Model to Assess Human Mesenchymal Progenitor Cell Potential. Stem Cell Rev. 2013, 9(6): 833-46. (A). IF: 4,52
- Isabel Mirones, Inmaculada de Prada, Ana M. Gómez, Alfonso Luque, Roberto Martín, M. Ángeles Pérez-Jiménez, Luis Madero, Javier García-Castro, Manuel Ramírez. A Role for the CXCR3/CXCL10 Axis in Rasmussen Encephalitis. Pediatric Neurology 2013, 49(6): 451-457. (A). IF: 1,40.
- Rodriguez-Milla MA, Mirones I, Mariñas-Pardo L, Melen GJ, Cubillo I, Ramírez M, García-Castro J. Enrichment of neural-related genes in human mesenchymal stem cells from neuroblastoma patients. Int J Mol Med. 2012, 30(2):365-73. (A). IF: 1,81.
- Abarrategi A, Marińas-Pardo L, Mirones I, Rincón E, García-Castro J. Mesenchymal niches of bone marrow in cancer. Clin Transl Oncol 2011, 13(9): 611-616. (R). IF: 1,25.
- Rodriguez R, Rubio R, Gutiérrez-Aranda I, Melen GJ, Elosua C, García-Castro J, Menendez P. Fus-Chop Fusion Protein Expression Coupled to P53 Deficiency Induces Liposarcoma in Mouse but not Human Adipose-Derived Mesenchymal Stem/Stromal Cells. Stem Cells 2011, 29(2):179-92. (A). IF: 7,87.
- Ramírez M, García-Castro J, Alemany R. Oncolytic virotherapy for neuroblastoma. Discov Med. 2010, 10 (54):387-393. (R). IF: 3,42.
- I García-Gómez, G Elvira, AG Zapata, ML Lamana, M Ramírez, J García-Castro, M García Arranz, A Vicente, J Bueren, D García-Olmo. Mesenchymal stem cells: biological properties and clinical applications. Expert Opinion Biol Ther. 2010, 10(10):1453-68. (R). IF: 3,21.
- Garcia S, Martín MC, de la Fuente R, Cigudosa JC, Garcia-Castro J, Bernad A. Pitfalls in spontaneous in vitro transformation of human mesenchymal stem cells. Experimental Cell Research 2010, 316(9):1648-50. (A). IF: 3,94.
- García-Castro J, Alemany R, Cascalló M, Martínez-Quintanilla J, Del Mar Arriero M, Lassaletta A, Madero L, Ramírez M. Treatment of metastatic neuroblastoma with systemic oncolytic virotherapy delivered by autologous mesenchymal stem cells: an exploratory study. Cancer Gene Therapy. 2010, 17(7):476-83. (A). IF: 3,00.
- Ruth Rubio, Javier García-Castro, Iván Gutiérrez-Aranda, Jesús Paramio, Mirentxu Santos, Purificación Catalina, Paola Leone, Pablo Menendez, René Rodríguez. Deficiency in p53 but not retinoblastoma induces the transformation of mesenchymal stem cells in vitro and initiates leiomyosarcoma in vivo. Cancer Research 2010, 70 (10): 4185-94. (A). IF: 7,51.
Publicaciones de los últimos 7 años:
- Higueras MA, Jimenez-Garcia L, Herranz S, Hortelano S, Luque A. Screening Assays to Characterize Novel Endothelial Regulators Involved in the Inflammatory Response. Journal of visualized experiments : JoVE. 2017(127). (A) IF: 1.232
- Olivar R, Luque A, Cardenas-Brito S, Naranjo-Gomez M, Blom AM, Borras FE, et al. The Complement Inhibitor Factor H Generates an Anti-Inflammatory and Tolerogenic State in Monocyte-Derived Dendritic Cells. J Immunol. 2016;196(10):4274-90. (A) IF: 4.856 Q1
- Jimenez-Garcia L, Traves PG, Lopez-Fontal R, Herranz S, Higueras MA, de Las Heras B, et al. 8,9-Dehydrohispanolone-15,16-lactol diterpene prevents LPS-triggered inflammatory responses by inhibiting endothelial activation. Biochem J. 2016;473(14):2061-71. (A) IF: 3.797
- Jimenez-Garcia L, Herranz S, Higueras MA, Luque A, Hortelano S. Tumor suppressor ARF regulates tissue microenvironment and tumor growth through modulation of macrophage polarization. Oncotarget. 2016. (A) IF: 5.168 Q1
- Garcia-Quintans N, Prieto I, Sanchez-Ramos C, Luque A, Arza E, Olmos Y, et al. Regulation of endothelial dynamics by PGC-1alpha relies on ROS control of VEGF-A signaling. Free Radical Bio Med. 2016;93:41-51. (A) IF:5.606 Q1
- Franco ML, Melero C, Sarasola E, Acebo P, Luque A, Calatayud-Baselga I, et al. Mutations in TrkA Causing Congenital Insensitivity to Pain with Anhidrosis (CIPA) Induce Misfolding, Aggregation, and Mutation-dependent Neurodegeneration by Dysfunction of the Autophagic Flux. J. Biol Chem. 2016;291(41):21363-74. (A) IF: 4.125
- Abos B, Wang T, Castro R, Granja AG, Leal E, Havixbeck J, et al. Distinct Differentiation Programs Triggered by IL-6 and LPS in Teleost IgM(+) B Cells in The Absence of Germinal Centers. Sci Rep. 2016;6:30004. (A) IF: 4.259 Q1
- Valenzuela-Barra G, Castro C, Figueroa C, Barriga A, Silva X, de Las Heras B, et al. Anti-inflammatory activity and phenolic profile of propolis from two locations in Region Metropolitana de Santiago, Chile. J Ethnopharmacol. 2015;168:37-44. (A) IF: 2.981 Q1
- Mota A, Jimenez-Garcia L, Herranz S, de Las Heras B, Hortelano S. alpha-Hispanolol sensitizes hepatocellular carcinoma cells to TRAIL-induced apoptosis via death receptor up-regulation. Toxicol Appl Pharm. 2015;286(3):168-77. (A) IF: 3.847 Q1
- Jimenez-Garcia L, Herranz S, Luque A, Hortelano S. Critical role of p38 MAPK in IL-4-induced alternative activation of peritoneal macrophages. Eur J Immunol. 2015;45(1):273-86. (A) IF: 4.179
- Gomez AM, Martinez C, Gonzalez M, Luque A, Melen GJ, Martinez J, et al. Chemokines and relapses in childhood acute lymphoblastic leukemia: A role in migration and in resistance to antileukemic drugs. Blood Cell Mol Dis 2015;55(3):220-7. (A) IF: 2.731
- Cuadrado-Berrocal I, Guedes G, Estevez-Braun A, Hortelano S, de Las Heras B. Biological evaluation of angular disubstituted naphthoimidazoles as anti-inflammatory agents. Bioorg Med Chem Lett. 2015;25(19):4210-3. (A) IF: 2.486
- Garcia-Quintans N, Sanchez-Ramos C, Tierrez A, Olmo Y, Luque A, Arza E, et al. Control of endothelial function and angiogenesis by PGC-1alpha relies on ROS control of vascular stability. Free Radical Bio Med. 2014;75 Suppl 1:S5. (A) IF:5.606 Q1
- Traves PG, Lopez-Fontal R, Cuadrado I, Luque A, Bosca L, de las Heras B, et al. Critical role of the death receptor pathway in the antitumoral effects induced by hispanolone derivatives. Oncogene. 2013;32(2):259-68. (A) IF: 8.559 Q1/D1
- Oramas-Royo S, Torrejon C, Cuadrado I, Hernandez-Molina R, Hortelano S, Estevez-Braun A, et al. Synthesis and cytotoxic activity of metallic complexes of lawsone. Bioorg Med Chem. 2013;21(9):2471-7. (A) IF:2.331
- Garaulet G, Alfranca A, Torrente M, Escolano A, Lopez-Fontal R, Hortelano S, et al. IL10 released by a new inflammation-regulated lentiviral system efficiently attenuates zymosan-induced arthritis. Mol Ther. 2013;21(1):119-30. (A) IF: 6.425 Q1/D1
- Traves PG, Luque A, Hortelano S. Macrophages, inflammation, and tumor suppressors: ARF, a new player in the game. Mediat Inflamm. 2012;2012:568783. (R) IF: 3.882
- Traves PG, Luque A, Hortelano S. Tumor suppressor ARF: The new player of innate immunity. Oncoimmunology. 2012;1(6):946-7. (R) IF: 7.719 Q1/D1
- Herranz S, Traves PG, Luque A, Hortelano S. Role of the tumor suppressor ARF in macrophage polarization: Enhancement of the M2 phenotype in ARF-deficient mice. Oncoimmunology. 2012;1(8):1227-38. (A) IF: 7.719 Q1/D1
- Cuadrado I, Cidre F, Herranz S, Estevez-Braun A, de las Heras B, Hortelano S. Labdanolic acid methyl ester (LAME) exerts anti-inflammatory effects through inhibition of TAK-1 activation. Toxicol Appl Pharmacol. 2012;258(1):109-17. (A) IF: 3.975 Q1
- Traves PG, Lopez-Fontal R, Luque A, Hortelano S. The tumor suppressor ARF regulates innate immune responses in mice. J Immunol. 2011;187(12):6527-38. (A) IF: 5.788 Q1
- Hueso-Falcon I, Cuadrado I, Cidre F, Amaro-Luis JM, Ravelo AG, Estevez-Braun A, et al. Synthesis and anti-inflammatory activity of ent-kaurene derivatives. Eur J Med Chem. 2011;46(4):1291-305. (A) IF: 3.346 Q1
- Lopez-Fontal R, Zeini M, Traves PG, Gomez-Ferreria M, Aranda A, Saez GT, et al. Mice lacking thyroid hormone receptor Beta show enhanced apoptosis and delayed liver commitment for proliferation after partial hepatectomy. PLoS One. 2010;5(1):e8710. (A) IF: 4.411 Q1
- Hueso-Falcon I, Giron N, Velasco P, Amaro-Luis JM, Ravelo AG, de las Heras B, et al. Synthesis and induction of apoptosis signaling pathway of ent-kaurane derivatives. Bioorg Med Chem. 2010;18(4):1724-35. (A) IF: 2.661
- Hortelano S, Lopez-Fontal R, Traves PG, Villa N, Grashoff C, Bosca L, et al. ILK mediates LPS-induced vascular adhesion receptor expression and subsequent leucocyte trans-endothelial migration. Cardiovasc Res. 2010; Qº186(2):283-92. (A) IF: 6.051 Q1/D1
- Giron N, Perez-Sacau E, Lopez-Fontal R, Amaro-Luis JM, Hortelano S, Estevez-Braun A, et al. Evaluation of labdane derivatives as potential anti-inflammatory agents. Eur J Med Chem. 2010;45(7):3155-61. (A) IF: 3.193 Q1
Nuestro principal objetivo es descubrir los mecanismos subyacentes al desarrollo y progresión de enfermedades raras y encontrar nuevas estrategias terapéuticas para luchar contra ellas.
Las tres líneas actuales de trabajo se resumen en el siguiente esquema:

Proyectos financiados durante los últimos 7 años:
- NÚMERO: SAF2010-19710. PROYECTO: Aurora A: funciones esenciales in vivo, validación como diana anti-tumoral e identificación de nuevos mecanismos de regulación. ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación; convocatoria de 2010 del Plan Nacional de I+D 2007-2010. DURACIÓN: 2011-2013. INVESTIGADOR PRINCIPAL: Ignacio Pérez de Castro Insúa.
- NÚMERO: PI14-00227. TÍTULO: Estudio integral de la inestabilidad cromosómica y cáncer. ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación; Acción Estratégica de Salud. DURACIÓN: 2015-2016. INVESTIGADOR PRINCIPAL: Ignacio Pérez de Castro Insúa.
- TÍTULO: Terapias Avanzadas para el Tratamiento de las Laminopatías. ENTIDAD FINANCIADORA: Fundación Andrés Marcio, niños contra la Laminopatía. DURACIÓN: 2016-2018. INVESTIGADOR PRINCIPAL: Ignacio Pérez de Castro Insúa y Fernando de Miguel Pedrero.
- NÚMERO: PI16CIII/00017. TÍTULO: Terapias avanzadas para el tratamiento de laminopatías: edición genómica y terapia celular con células progenitoras mesenquimales. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud Intramural 2016. DURACIÓN: 2016-2018. INVESTIGADOR PRINCIPAL: Fernando de Miguel Pedrero.
- NÚMERO: SAF2016-76929-R TÍTULO: Inestabilidad cromosómica y cáncer: una aproximación multidisciplinar para la búsqueda de nuevos biomarcadores y de oportunidades terapéuticas. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad; Retos de la Sociedad. DURACIÓN: 2017-2019. INVESTIGADOR PRINCIPAL: Ignacio Pérez de Castro Insúa.
- TÍTULO: Uso del editado génico mediado por CRISPR para el estudio y tratamiento del cáncer de ovario de células de la granulosa. ENTIDAD FINANCIADORA: AECC, Ideas Semilla 2017. DURACIÓN: 2017-2018. INVESTIGADOR PRINCIPAL: Ignacio Pérez de Castro Insúa.
- NÚMERO: PI17CIII/00010. TÍTULO: Nuevos biomarcadores y tratamientos antitumorales basados en inestabilidad romosómica. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud Intramural 2017. DURACIÓN: 2017-2019. INVESTIGADOR PRINCIPAL: Alberto Martín Martín.
Agencias financiadoras:

- • Regulación epigenética de la identidad el músculo estriado y su implicación en enfermedades raras del tipo de las miopatías idiopáticas y problemas de conducción cardiaca, tales como la fibrilación atrial y el bloqueo atrioventricular.
- • Ensayos Funcionales de Nuevas Mutaciones en Enfermos no Diagnosticados.
LÍNEAS DE INVESTIGACIÓN
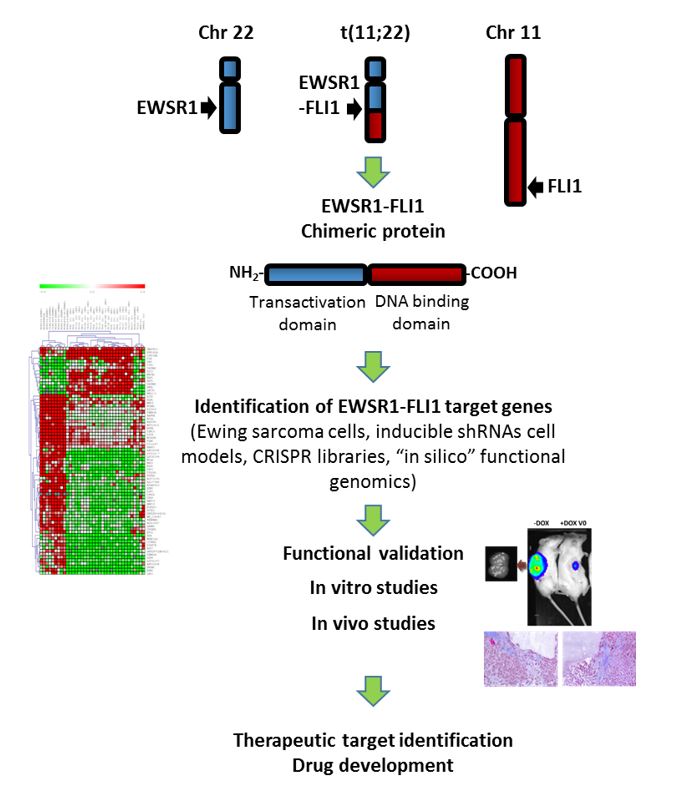
1) Bases moleculares del sarcoma de Ewing. Identificación de nuevas dianas terapéuticas.
El sarcoma de Ewing es un tumor pediátrico muy agresivo que se caracteriza desde el punto de vista genético por la presencia de traslocaciones cromosómicas que dan lugar a factores de transcripción aberrantes formados por la fusión de dos genes (principalmente EWSR1 y FLI1). Estos factores de transcripción quiméricos (p. ej. EWSR1-FLI1) inducen e inhiben la expresión de genes que son claves en el proceso tumorogénico. Uno de nuestros principales objetivos es la caracterización funcional de los genes diana de EWSR1-FLI1 que están implicados en el desarrollo del tumor con el objeto de identificar nuevas dianas terapéuticas.
Agencias financiadoras:

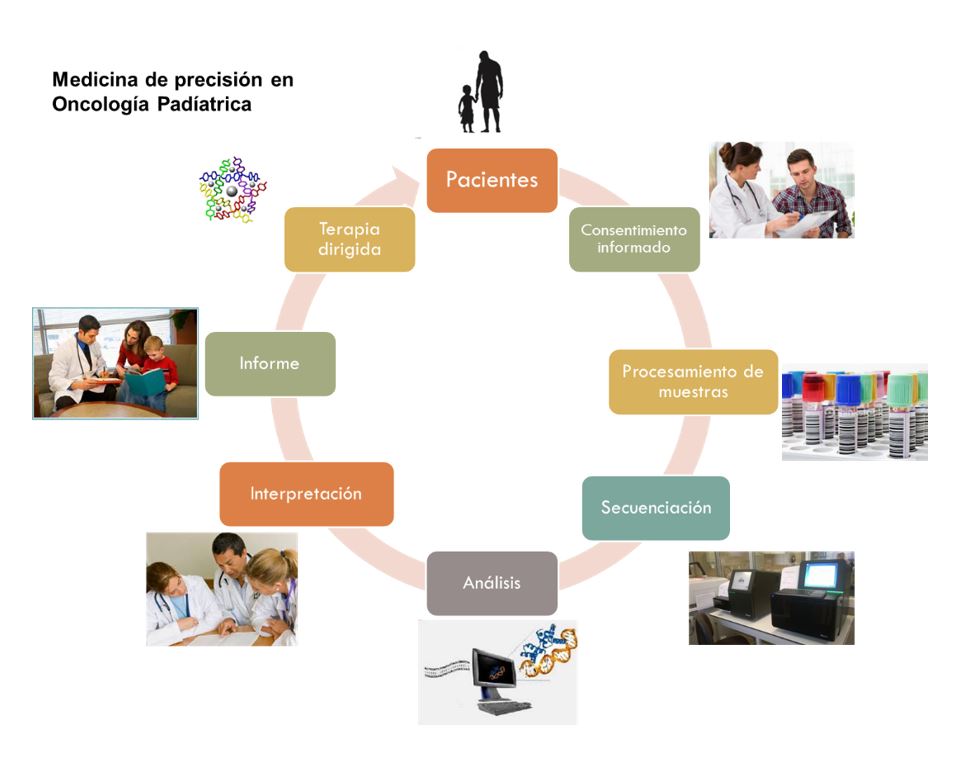
2) Caracterización genética de tumores infantiles. Programa de medicina de precisión en cáncer infantil
El objetivo de este proyecto es evaluar la utilidad de la secuenciación masiva para caracterizar las alteraciones genéticas tumorales presentes en pacientes con cáncer infantil y valorar, en el contexto de un equipo multidisciplinar, la utilidad diagnóstica, pronóstica y terapéutica de las alteraciones identificadas.
Este proyecto está abierto a colaboraciones con los servicios de oncología pediátrica interesados en el mismo.
Agencias financiadoras:

Proyectos de investigación (últimos cinco años)
- PROYECTO: Papel de las proteínas matricelulares en el desarrollo y progresión del sarcoma de Ewing: Implicaciones pronósticas y terapéuticas. ENTIDAD FINANCIADORA: Acción Estratégica en Salud Intramural (ISCIII-AESI) (PI16CIII/00026). INVESTIGADOR PRINCIPAL: Fco. Javier Alonso. DURACIÓN Y CUANTÍA: 2017-2019; 168.950 €
- PROYECTO: Identificación de mosaicismos en pacientes con retinoblastoma mediante secuenciación masiva y caracterización molecular de retinomas y retinoblastomas: Implicaciones terapéuticas. ENTIDAD FINANCIADORA: Acción Estratégica en Salud (ISCIII-AES) (PI12/00816). INVESTIGADOR PRINCIPAL: Fco. Javier Alonso. DURACIÓN Y CUANTÍA: 2013-2015; 146.894 €
- PROYECTO: Red Temática Investigación Cooperativa en Cáncer. Programa 7, Otros tumores y pediátricos. ENTIDAD FINANCIADORA: Acción Estratégica en Salud. Redes Temáticas de Investigación Cooperativa (RD12/0036/0027). INVESTIGADOR PRINCIPAL: Javier García Castro (Nodo ISCIII-IIER). DURACIÓN Y CUANTÍA: 2013-2016
- PROYECTO: Caracterización genética y funcional de la histiocitosis pulmonar de células de Langerhans: Implicaciones diagnósticas y terapéuticas. ENTIDAD FINANCIADORA: Fundación Mutua Madrileña. INVESTIGADOR PRINCIPAL: Diego Castillo (Hospital Sant Pau de Barcelona). DURACIÓN Y CUANTÍA: 2013-2015; 24.000 €
- PROYECTO: Proyecto La Sonrisa de Alex para la investigación en cáncer infantil. ENTIDAD FINANCIADORA: Fundación la Sonrisa de Alex (TVP-1324/15). INVESTIGADOR PRINCIPAL: Fco. Javier Alonso. DURACIÓN Y CUANTÍA: 2015-2018; 82.000 €
- PROYECTO: Proyecto Pablo Ugarte para la investigación en sarcoma de Ewing. ENTIDAD FINANCIADORA: Asociación Pablo Ugarte (TPY-M 1149/13). INVESTIGADOR PRINCIPAL: Fco. Javier Alonso. DURACIÓN Y CUANTÍA: 2013-2019; 180.825 €
- PROYECTO: Proyecto Genoma del Cáncer Infantil. ENTIDAD FINANCIADORA: La Hucha de Tomás - ASION (TVP 1278/12) INVESTIGADOR PRINCIPAL: Fco. Javier Alonso. DURACIÓN Y CUANTÍA: 2013-2015; 53.000 €
Agencias financiadoras:

Proyectos de Investigación (últimos siete años):
- NÚMERO: PI17/00013. TÍTULO DEL PROYECTO: Optimización de la viroinmunoterapia Celyvir como tratamiento de tumores pediátricos. ENTIDAD FINANCIADORA: Fondo de Investigaciones Sanitarias. DURACIÓN: 2018-2020. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: B2017/BMD-3692. TÍTULO DEL PROYECTO: Terapias avanzadas de precisión en regeneración y reparación celular y tisular (Red AvanCell). ENTIDAD FINANCIADORA: Comunidad de Madrid. DURACIÓN: 2018-2020. IP RED: Francisco Fernández Avilés. INVESTIGADOR PRINCIPAL: Javier García Castro
- NÚMERO: PI14/00005. TÍTULO DEL PROYECTO: Activación de células progenitoras mesenquimales como nueva inmunoterapia frente al cáncer. ENTIDAD FINANCIADORA: Fondo de Investigaciones Sanitarias. DURACIÓN: 2015-2017. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: -- . TÍTULO DEL PROYECTO: Potenciando las inmunoterapias en sarcomas pediátricos. ENTIDAD FINANCIADORA: Asociación Pablo Ugarte. DURACIÓN: 2017- . INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: -- . TÍTULO DEL PROYECTO: Terapias combinadas en osteosarcomas. ENTIDAD FINANCIADORA: AFANION. DURACIÓN: 2017-2020. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: TVP 1316/13. TÍTULO DEL PROYECTO: Papel del sistema inmune en la resistencia a las terapias antitumorales. ENTIDAD FINANCIADORA: MERCK España. DURACIÓN: 2013-2017. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: RD12/0036/0027. TÍTULO DEL PROYECTO: Red Temática Investigación Cooperativa en Cáncer. ENTIDAD FINANCIADORA: Fondo de Investigaciones Sanitarias. DURACIÓN: 2013-2016. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: MPY 1052/12. TÍTULO DEL PROYECTO: Una nueva generación de medicamentos celulares más eficaces y seguros (CELLCAM). ENTIDAD FINANCIADORA: Comunidad de Madrid. DURACIÓN: 2012-2016. IP RED: Juan Bueren Roncero. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: PI11/00377. TÍTULO DEL PROYECTO: Biología celular de los osteosarcomas. ENTIDAD FINANCIADORA: Fondo de Investigaciones Sanitarias. DURACIÓN: 2012-2014. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: PI10/02985. TÍTULO DEL PROYECTO: Hybrid Nanostuctured Hydrogels: Bone regeneration using multifunctional injectable hydrogels. ENTIDAD FINANCIADORA: EuroNanoMed. DURACIÓN: 2011-2014. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: SA/12/AYU/197. TÍTULO DEL PROYECTO: Generación de células mesenquimales humanas con potencial osteogénico mejorado genéticamente para su uso en implantes destinados a regeneración ósea. ENTIDAD FINANCIADORA: Fundación Mapfre. DURACIÓN: 2013. INVESTIGADOR PRINCIPAL: Arantzazu Alfranca.
- NÚMERO: MVI 1418/10. TÍTULO DEL PROYECTO: Influencia del microambiente medular sobre células de leucemia linfoblastica aguda infantil: papel de la vía de señalización BMP2/4. ENTIDAD FINANCIADORA: Fundación Científica AECC. DURACIÓN: 2010-2013. INVESTIGADOR PRINCIPAL: Agustín Zapata.
- NÚMERO: PLE2009-0115. TÍTULO DEL PROYECTO: Utilización de células madre adultas como agentes terapéuticos antitumorales. ENTIDAD FINANCIADORA: MICINN. DURACIÓN: 2010-2013. INVESTIGADOR PRINCIPAL: Javier García Castro.
- NÚMERO: EC11-061. TÍTULO DEL PROYECTO: Ensayo clínico de seguridad y eficacia de infusiones repetidas de CELYVIR en niños y adultos con tumores sólidos metastásicos y refractarios. ENTIDAD FINANCIADORA: Fondo de Investigaciones Sanitarias. DURACIÓN: 2012. INVESTIGADOR PRINCIPAL: Manuel Ramírez Orellana.
Agencias financiadoras:

El objetivo de nuestro grupo es comprender los mecanismos que regulan los procesos inflamatorios buscando un mejor entendimiento de las señales implicadas en la puesta en marcha de este proceso y en la resolución del mismo, como una de las primeras líneas de intervención frente a diversas patologías, entre las que destacan las enfermedades raras. Además trabajamos en el diseño y la identificación de nuevos agentes terapéuticos a partir de productos naturales.
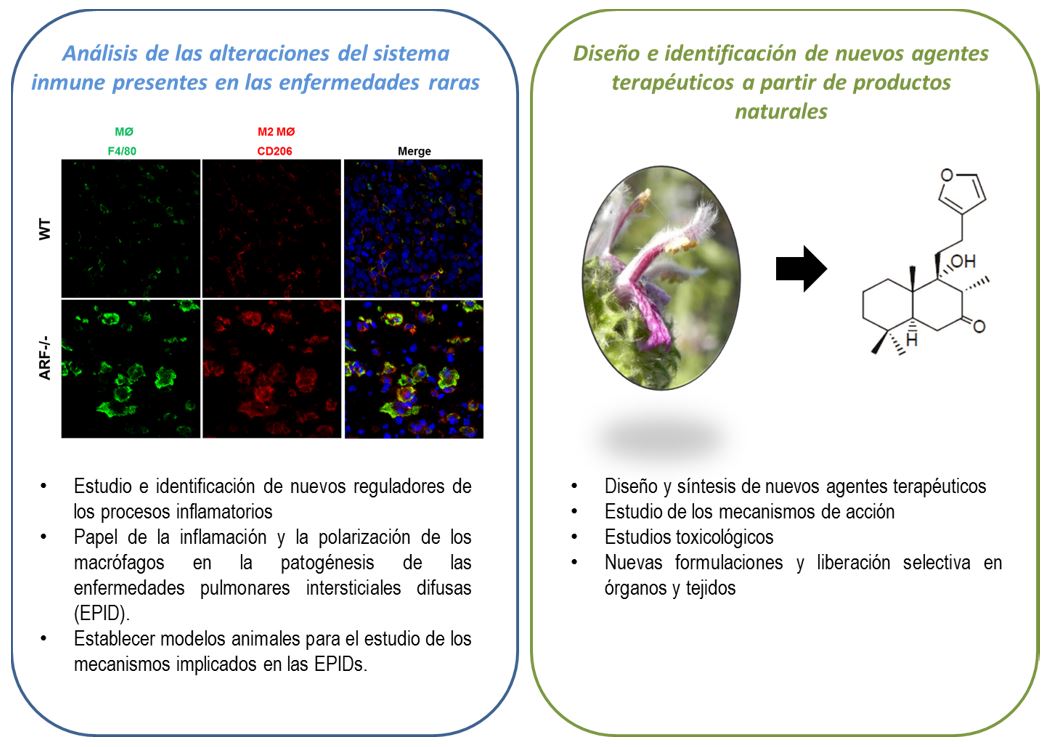
PROYECTOS FINANCIADOS (últimos 7 años)
- Número: PI17CIII/00012. TÍTULO DEL PROYECTO: La inflamación y los macrófagos como potenciales dianas en enfermedades intersticiales pulmonares. Estudio de nuevos reguladores y agentes terapéuticos. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud Intramural 2017. PI17CIII/00012. DURACION: 01/01/2018 - 31/12/2020. INVESTIGADOR PRINCIPAL: Sonsoles Hortelano.
- Número: IERPY 1149/16. Título del Proyecto: Contribución del endotelio vascular a la patología inflamatoria y fibrótica en las enfermedades pulmonares raras. Entidad financiadora: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud Intramural 2015, IERPY 1149/16. Duración: 2016-2018. Investigador PrinciPal: Dr. Alfonso Luque Jiménez. Financ.: 106.497,64 €
- Número: PI14/00055. TÍTULO DEL PROYECTO: Estudio de la polarización de macrófagos en enfermedades intersticiales pulmonares. Búsqueda de biomarcadores e implementación de un nuevo modelo animal. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud Intramural 2014. PI14/00055. DURACION: 01/01/2015 - 31/12/2017. INVESTIGADOR PRINCIPAL: Sonsoles Hortelano. Cuantía total: 205.502,6.
- Número: TVP 1316/13. Título del Proyecto: Impulso de investigación del sistema inmune en la resistencia de las terapias antitumorales. Entidad financiadora: Merck, S.L.U. Proyecto de colaboración entre Merck y IIER-ISCIII. TVP 1316/13. Duración: 2014-2017. Investigador Principal: Dra. Arantza Alfranca González. Cuantía total: 180.000 €
- Número: TPY-M 1068/13. TÍTULO DEL PROYECTO: Regulation of the polarization of tumor associated macrophages by the ARF gene and its functionality on tumor angiogenesis". ENTIDAD FINANCIADORA: Instituto Salud Carlos III. TPY-M 1068/13. DURACION: 2013-2016. INVESTIGADOR PRINCIPAL Alfonso Luque Jiménez. Cuantía total: 121.500 €.
- Número: TPI 1388/12. PROYECTO: Red Temática Investigación Cooperativa en Cáncer (RTICC). ENTIDAD FINANCIADORA: FIS (Fondo de Investigaciones Sanitarias; número expediente RD12/0036/0027). TPI 1388/12. INVESTIGADOR PRINCIPAL (red): Eugenio Santos de Dios. INVESTIGADOR PRINCIPAL (programa): Enrique de Álava Casado. DURACION: 2013-2016.
- TÍTULO DEL PROYECTO: CARACTERIZACIÓN GENÉTICA Y FUNCIONAL DE LA HISTIOCITOSIS PULMONAR DE CÉLULAS DE LANGERHANS: IMPLICACIONES DIAGNÓSTICAS Y TERAPÉUTICAS. ENTIDAD FINANCIADORA: Fundación Mutua Madrileña. INVESTIGADOR PRINCIPAL Diego Castillo. DURACION: 2013- 2016.
- TÍTULO DEL PROYECTO: CARACTERIZACIÓN GENÉTICA Y FUNCIONAL DE LA HISTIOCITOSIS PULMONAR DE CÉLULAS DE LANGERHANS: IMPLICACIONES DIAGNÓSTICAS Y TERAPÉUTICAS. ENTIDAD FINANCIADORA: CONVOCATORIA AYUDAS INTERMUNE-EPIC FUTURO (PII EPID) 2013. INVESTIGADOR PRINCIPAL Diego Castillo.DURACION: 2013- 2016.
- Número: FIS PI11/0036. TÍTULO DEL PROYECTO: Re-educando a los macrófagos. Papel del gen supresor de tumores ARF en la polarización de los macrófagos asociados a tumores. INVESTIGADOR PRINCIPAL: Sonsoles Hortelano. ENTIDAD FINANCIADORA: Ministerio de Economía y Competitividad, Proyectos de Investigación en Salud-ISCIII, Acción Estratégica en Salud 2011. FIS PI11/0036. DURACIÓN 2012-201. IMPORTE: 104.362,50
Las líneas de investigación desarrolladas se engloban en 4 áreas temáticas:
- Epidemiología de los defectos congénitos
- Genética clínica
- Citogenética y genética molecular
- Teratología clínica
Proyectos/convenios más recientes:
- "Análisis clínico-epidemiológico del Registro de IVEs por defectos congénitos del ECEMC". Entidad financiadora: Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación). Expte: TPY 028/09 (Programa de Ayudas de Investigación a Grupos Emergentes). IP: Eva Bermejo Sánchez. 2009-2011.
- "Very Rare Defects Project" (Subprojects on: Acardia, Amelia, Cyclopia, Cloacal Exstrophy, Bladder Exstrophy, Phocomelia, Conjoined twins, and Sirenomelia). Entidad financiadora: International Clearinghouse for Birth Defects Surveillance and Research (ICBDSR). IP de los subproyectos sobre Amelia y Focomelia: Eva Bermejo-Sánchez. (IP Cyclopia: I.M. Orioli, Brasil; IP Cloacal Exstrophy: M. Feldkamp, EE.UU; IP Bladder Exstrophy: C. Siffel, EE.UU.; IP Conjoined Twins: O. Mutchinick, Méjico; IP Sirenomelia: I.M. Orioli, Brasil). 2010-2011.
- "EUROCAT Joint Action" (Ref: 2010 22 04). Entidad financiadora: Executive Agency for Health and Consumers. EU Health Programme 2008-2013. IP: H. Dolk, Reino Unido. 2011-2013.
- "Investigación sobre los aspectos clínicos y etiológicos de las fisuras cráneo-faciales atípicas congénitas (FCFAC)". Entidad financiadora: Instituto de Salud Carlos III (Convocatoria de Ayudas de Proyectos de Investigación en Salud, de la Acción Estratégica de Salud. Expte: PI12/00759. IP: Eva Bermejo Sánchez. 2013-2016.
- "Collaborative project on the frequency of hypospadias". Entidad financiadora: International Clearinghouse for Birth Defects Surveillance and Research (ICBDSR). IPs: A.J. Agopian (EE.UU.) y N. Nassar (Australia). 2015-2017.
- "Collaborative projects on the mortality/survival of selected non-cardiac defects" (varios subproyectos). Entidad financiadora: International Clearinghouse for Birth Defects Surveillance and Research (ICBDSR). Varios IPs. 2016-2018.
- "ICBDSR-Global Epidemiology of Gastroschisis Project". Entidad financiadora: International Clearinghouse for Birth Defects Surveillance and Research (ICBDSR). Varios IPs. 2016-2018.
- Convenios anuales ISCIII-ASEREMAC para "Investigación epidemiológica y causal de los defectos congénitos". Entidad financiadora: Instituto de Salud Carlos III. IP hasta 2016: M.L. Martínez-Frías. Investigador responsable en 2017: Eva Bermejo-Sánchez.
PROYECTO: Spanish Rare Disease Registries Research Network (Spain-RDR). ENTIDAD FINANCIADORA: International Rare Diseases Research Consortium (IRDiRC) - FIS. Desde: 2011 Hasta 2015; Importe: 397.600€. INVESTIGADOR PRINCIPAL: Manuel Posada de la Paz.
PROYECTO: RD-CONNECT: An integrated platform connecting registries, biobanks and clinical bioinformatics for Rare Diseases research. ENTIDAD FINANCIADORA: UE, 7º Programa Marco. Desde: 2012 Hasta 2018; Importe: 397.410€. INVESTIGADOR PRINCIPAL: Hanns Lochmüller en Europa y Manuel Posada de la Paz en España.
PROYECTO: RD-CONNECT: Epidemiología de las Enfermedades Raras. ENTIDAD FINANCIADORA: ISCIII intramural. Desde: 2012 Hasta 2014; Importe: 63.104€. INVESTIGADOR PRINCIPAL: Verónica Alonso.
PROYECTO: RARE-Bestpractices-Platform for sharing best practices for management of rare diseases. ENTIDAD FINANCIADORA: UE, 7º Programa Marco. Desde: 2013 Hasta 2016; Importe: 60.000€. INVESTIGADOR PRINCIPAL: Domenica Taruscio en Europa y Manuel Posada de la Paz en España.
PROYECTO: Social-economic burden and health-related quality of life in patients with Systemic Lupus Erythematosus. ENTIDAD FINANCIADORA: FIS (AES). Desde: 2014 Hasta 2016; Importe: 15.981€. INVESTIGADOR PRINCIPAL: Renata Linertova.
PROYECTO: Mortalidad atribuible a enfermedades raras en España, 1981-2010. Sistema de información interactivo de la variabilidad temporal y geográfica. ENTIDAD FINANCIADORA: FIS (AESI). Desde: 2015 Hasta 2017; Importe: 30.705 €. INVESTIGADOR PRINCIPAL: Verónica Alonso.